
| A. | 5.6 g铁与足量盐酸反应转移的电子数为0.3NA | |
| B. | 标准状况下,11.2LSO3所含的分子数为0.5NA | |
| C. | 标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2 NA | |
| D. | 20 g重水(D2O)中含有的电子数为10NA |
分析 A、铁与盐酸反应生成氯化亚铁和氢气,铁由0价升高为+2价,根据铁计算注意的电子数;
B.标准状况下SO3为固体;
C、氦气是单原子分子;
D、D2O中含有10个电子,摩尔质量是20g/mol.
解答 解:A、5.6g铁的物质的量为0.1mol,铁与盐酸反应生成氯化亚铁和氢气,铁由0价升高为+2价,转移的电子数为0.1mol×2×NAmol-1=0.2NA,故A错误;
B.标准状况下SO3为固体,Vm≠22.4L/mol,无法计算物质的量,故B错误;
C、标准状况下,22.4L氦气所含原子数为NA,22.4L氟气所含原子数为2NA,故C错误;
D、20g重水(D2O)的物质的量是1mol,D2O分子中含有10个电子,含有的电子数为10NA,故D正确;
故选D.
点评 本题考查阿伏伽德罗常数,注意气体摩尔体积的条件应用,物质的量和微粒数的计算分析,本题难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 甲醇是一种低碳能源,在全球能源危机和环境污染的背景下具有良好的发展前景.在催化剂作用下可用H2和CO合成甲醇,反应的化学方程式为2H2(g)+CO(g) $\stackrel{催化剂}{?}$CH3OH(g),三种物质的物质的量浓度随时间变化的关系如图1所示.试回答下列问题:
甲醇是一种低碳能源,在全球能源危机和环境污染的背景下具有良好的发展前景.在催化剂作用下可用H2和CO合成甲醇,反应的化学方程式为2H2(g)+CO(g) $\stackrel{催化剂}{?}$CH3OH(g),三种物质的物质的量浓度随时间变化的关系如图1所示.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀铜制印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | NH4HCO3溶液和过量的NaOH溶液相混合:HCO3-+OH-═CO32-+H2O | |
| C. | 向Fe2(SO4)3的酸性溶液中通入足量H2S:Fe3++H2S═FeS↓+2H+ | |
| D. | FeI2溶液中通入Cl2至I-恰好完全被氧化:2I-+Cl2═I2+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和食盐水:C1-+2H2O═H2↑+Cl2↑+OH- | |
| B. | 氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e-═4OH- | |
| C. | 弱酸酸式盐NaHB在水溶液中水解:HB-+H2O═H3O++B2- | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷与Cl2反应制氯乙烷 | |
| B. | 乙醇和浓硫酸共热制乙烯 | |
| C. | 乙酸和乙醇共热酯化 | |
| D. | 乙烯在催化剂作用下直接氧化制得唯一产物乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
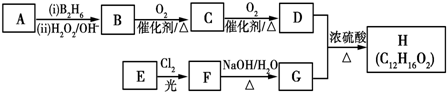
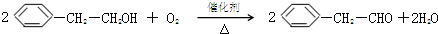 .
. .
.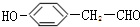 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com