
分析 ①先根据v=$\frac{\frac{△n}{V}}{△t}$计算出平衡时用c表示的反应速率,然后根据反应速率与化学计量数成正比计算出m;
②根据生成c的物质的量计算出消耗b的物质的量,然后可得出b的转化率;
③根据化学反应速率与化学计量数的关系计算出a的平均反应速率.
解答 解:①经5min后达到平衡,此时c为0.2mol,则c的平均反应速率为:v(c)=$\frac{\frac{0.2mol}{0.4L}}{5min}$=0.1mol/(L•min),又知在此反应期间d的平均反应速率为0.1mol•L-1•min-1,根据反应速率与化学计量数成正比可知m:1=0.1mol/(L•min):0.1mol/(L•min),解得:m=1,
故答案为:1;
②平衡时生成0.2molc,根据反应2a+b?c+d可知,反应消耗b的物质的量为0.2mol,则b的转化率为:$\frac{0.2mol}{0.5mol}$×100%=40%,
故答案为:40%;
③在此反应期间d的平均反应速率为0.1mol•L-1•min-1,则a的平衡反应速率为:v(a)=2v(d)=0.1mol•L-1•min-1×2=0.2mol•L-1•min-1,
故答案为:0.2 mol•L-1•min-1.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学反应速率与化学计量数的关系为解答关键,注意掌握化学平衡及其影响因素,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:多选题
| A. | 氨水稀释后,溶液中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的值减小 | |
| B. | 0.1 mol•L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH减小 | |
| C. | 298 K时,2H2S(g)+SO2(g)═3S(s)+2H2O(l)能自发进行,则其△H<0 | |
| D. | 对N2(g)+3H2(g)═2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在氧气中燃烧,钠的氧化产物: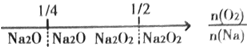 | |
| B. | 铁在Cl2中燃烧,铁的氧化产物: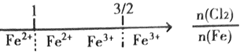 | |
| C. | A1Cl3溶液中滴加NaOH溶液后体系中铝元素的存在形式: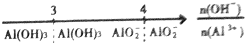 | |
| D. | FeI2溶液中通入Cl2,铁元素存在形式: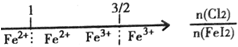 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
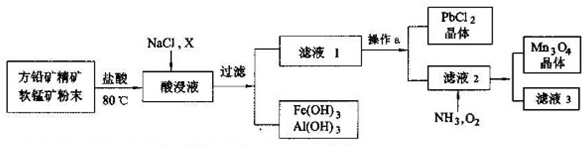
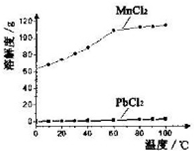
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
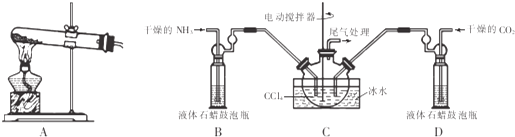
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
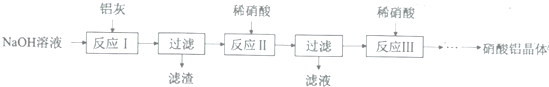
| 氢氧化物 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 4.2 |
| 沉淀完全pH | 3.2 | 5.4 |
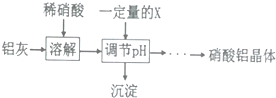
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
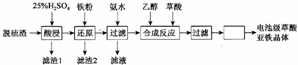
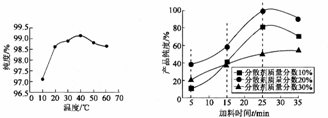
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸与NaOH溶液反应:2H++OH-=H2O | |
| B. | AgNO3溶液与NaCl溶液反应:Ag++Cl-=AgCl↓ | |
| C. | CaCO3与稀盐酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | Fe片插入FeCl3溶液中:Fe+Fe3+=2Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com