
| A. | 纯锌与稀硫酸反应时,加少量CuSO4溶液,可使反应速率加快 | |
| B. | 甲烷和氧气以及KOH溶液构成的新型燃料电池中,负极上发生的反应为CH4+8OH-+8e-═CO2+6H2O | |
| C. | 把铜片和铁片紧靠在一起浸入稀H2SO4中,铁片表面出现气泡 | |
| D. | 把铜片插入FeCl3溶液中,在铜片表面出现一层铁 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
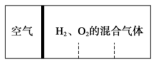 (1)8.4g N2与9.6g某单质Rx所含原子个数相同,且分子数之比为3:2,则R的相对原子质量是16,x值为3.
(1)8.4g N2与9.6g某单质Rx所含原子个数相同,且分子数之比为3:2,则R的相对原子质量是16,x值为3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 122.5 g KClO 3中含Cl-数目为NA | |
| B. | 1 mol/L的NaOH溶液中含Na+数目为NA | |
| C. | 标准状况下,22.4 L水中含氢原子数目为2NA | |
| D. | 常温常压下,32 g S03中含氧原子数目为1.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=a+1 | |
| B. | 在滴有酚酞的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 | |
| C. | 常温下,1.0×10-3 mol/L盐酸的pH=3.0,1.0×10-8mol/L 盐酸的pH=8.0 | |
| D. | 电解质不一定导电,导电物质不一定是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+H+═H2O+CO2 | |
| B. | 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2 | |
| C. | 硝酸与氢氧化钡反应:OH-+H+═H2O | |
| D. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途.完成下列填空:
氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2O+O2+4e-=4OH- | B. | Fe-2e-=Fe2+ | ||
| C. | 2H++2e-=H2↑ | D. | Fe-3e-=Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com