
【题目】硼氢化钠(NaBH4)具有优良的还原性,在有机化学和无机化学领域有着广泛的应用。利用硼精矿(主要成分为B2O3,含有少量Al2O3、SiO2、FeCl3等![]() 制取NaBH4的流程如图:
制取NaBH4的流程如图:

已知:偏硼酸钠(NaBO2)易溶于水,不溶于醇,在碱性条件下稳定存在,回答下列问题:
(1)写出加快硼精矿溶解速率的措施______![]() 写一种
写一种![]() 。
。
(2)操作1为______,滤渣主要成分为______。
(3)除硅铝步骤加入CaO而不加入CaCl2的原因有:①能将硅、铝以沉淀除去;②______.
(4)氢化镁(MgH2)中H元素的化合价为______;MgH2与NaBO2在一定条件下发生反应1,其化学方程式为:______。
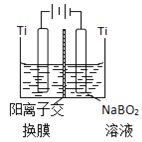
(5)如图在碱性条件下,在阴极上电解NaBO2也可制得硼氢化钠,写出阴极室的电极反应式______。
(6)硼氢化钠是一种强还原剂,碱性条件可处理电镀废液中的硫酸铜制得纳米铜,从而变废为宝,写出该反应的离子方程式______。
【答案】将硼精矿粉碎、搅拌、增大NaOH浓度、升温等 过滤 Fe(OH)3 提供碱性溶液抑制NaBO2水解 -1 2MgH2+ NaBO2= NaBH4+2MgO BO2-+6H2O+8e-= BH4-+8OH- 4Cu2++ BH4-+8OH-=4Cu+BO2-+6H2O
【解析】
硼精矿碱浸时,生成偏硼酸钠、偏铝酸钠、硅酸钠的混合液,氯化铁不溶于碱,则滤渣为氢氧化铁;向滤液中加入氧化钙,除去硅、铝元素,生成固体Na2O3CaOAl2O3nSiO2,过滤后,加入氢化镁,生成硼氢化钠和氧化镁。
(1)将硼精矿粉碎、搅拌、增大NaOH浓度、升温等都可以加快硼精矿溶解速率;
(2)根据以上分析,操作1为过滤,滤渣主要成分为Fe(OH)3;
(3)因为在NaBO2溶液除去硅铝,NaBO2易溶于水,在碱性条件下稳定存在,所以除硅铝步骤加入CaO而不加入CaCl2的原因有:①能将硅、铝以沉淀除去;②提供碱性溶液抑制NaBO2水解;
(4)根据化合价代数和为0,则氢化镁(MgH2)中H元素的化合价为-1;MgH2与NaBO2在一定条件下发生反应生成NaBH4和MgO,则反应方程式为:2MgH2+ NaBO2= NaBH4+2MgO;
(5)在阴极上电解NaBO2也可制得硼氢化钠,则阴极室BO2-得电子发生还原反应生成BH4-,则电极反应式为:BO2-+6H2O+8e-= BH4-+8OH-;
(6)硼氢化钠是一种强还原剂,碱性条件可处理电镀废液中的硫酸铜制得纳米铜,则反应的离子方程式为:4Cu2++ BH4-+8OH-=4Cu+BO2-+6H2O。


科目:高中化学 来源: 题型:
【题目】CO2与CH4可制得合成气:CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH=+247 kJ·mol-1。初始温度均为T K时,在3个容器中按不同方式投入反应物,发生上述反应,相关信息如下表:
容器 | 起始物质的量/mol | CO2平衡转化率(α) | |||||
编号 | 容积/L | 条件 | CH4(g) | CO2(g) | CO(g) | H2(g) | |
Ⅰ | 2 | 恒温恒容 | 2 | 1 | 0 | 0 | 50% |
Ⅱ | 1 | 0.5 | 1 | 0 | 0 | ||
Ⅲ | 1 | 绝热恒容 | 1 | 0.5 | 0 | 0 | - |
下列说法正确的是
A.T K时,反应CH4(g)+CO2(g)2CO(g)+2H2(g)的平衡常数为1/3
B.容器Ⅱ中反应达到平衡时,α(CO2,Ⅱ)=50%
C.容器Ⅲ中反应达到平衡时反应热在123.5—247 kJ·mol-1范围内
D.容器Ⅱ中反应达到平衡时,再投入0.5 mol CH4、0.25 mol CO,反应达到新平衡前,v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一固定容积的密闭容器中进行如下反应N2+3H2![]() 2NH3,下列情况一定能说明反应已达到平衡的是
2NH3,下列情况一定能说明反应已达到平衡的是
①容器内压强不随时间而变化
②单位时间内,有3molH2反应,同时有2molNH3生成
③气体的密度不随时间而变化
④单位时间内,有1molN2生成,同时有2molNH3生成
⑤用N2、H2、NH3表示的该反应的化学反应速率之比为1∶3∶2
⑥气体的平均摩尔质量不随时间而变化
A.①④⑥ B.①②③ C. ②③⑤ D.①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年2月,国家卫生健康委办公厅、国家中医药管理局办公室联合发出《关于印发新型冠状病毒肺炎诊疗方案(试行第六版)的通知》。此次诊疗方案抗病毒治疗中增加了有机物G,G是一种医药中间体,可通过如图所示路线合成。A是石油化工的重要产品且分子中所有原子在同一平面内,H的分子式是C7H8。
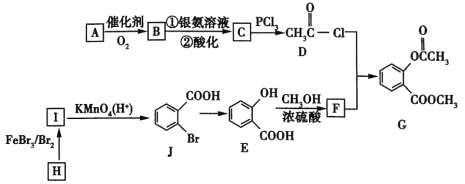
已知:![]() 。
。
回答下列问题。
(1)A的结构简式是___________。
(2)H→I的化学方程式为__________,B与银氨溶液反应的化学方程式是__________。
(3)C→D的反应类型是______,I→J的反应类型是______。
(4)两个E分子在一定条件下发生分子间脱水生成一种环状酯的结构简式是_______________。
(5)满足以下条件的F的同分异构体(不含F)共有_________种。
①能与氯化铁溶液发生显色反应 ②分子中有—COO—结构 ③苯环上有两个取代基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiCl4是制备钛及其化合物的重要中间体,可利用下列装置在实验室制备TiCl4(夹持装置略去): TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
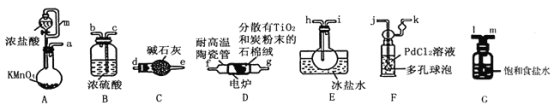
已知:①PdCl2溶液捕获CO时生成Pd单质;②相关数据如下表:
化合物 | 熔点/℃ | 沸点/℃ | 密度/gcm-3 | 溶解性 |
TiCl4 | -25 | 136 | 1.5 | 能溶于有机溶剂:遇水分解生成难溶于水的物质 |
CCl4 | -23 | 76.8 | 1.6 | 难溶于水 |
回答下列问题:
(1)装置A中连通管的作用是______;装置E中使用冰盐水浴的目的是_____________________。
(2)按照气流由左到右的方向,上述装置合理的连接顺序为____________________ (填仪器接口字母);根据完整的实验装置进行实验,实验步骤如下:_____________; 装入药品;向装置A烧瓶中滴加适量浓盐酸,当观察到_________时,加热装置D中陶瓷管;装置E烧瓶中的液体量不再增加时,停止加热,充分冷却。
(3)装置C的作用为___________________。
(4)装置F中发生反应的化学方程式为________________________。
(5)制得的TiCl4中常含有少量CCl4, 从混合液体中分离出TiCl4的操作名称为_______________。
(6)利用如图所示装置测定产品纯度:称取w g TiCl4产品进行实验,向安全漏斗中加入适量蒸馏水,待四氯化钛充分反应后,将烧瓶和安全漏斗中的液体一并转入锥形瓶中,用氢氧化钠溶液调节至中性,滴加几滴0.1 molL-1的K2CrO4溶液作指示剂,用cmol L-1 AgNO3标准溶液滴定至终点( Ag2CrO4为红棕色沉淀,可指示滴定终点),重复滴定两次,平均消耗标准溶液V mL。
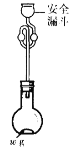
已知:TiCl4 +(2+x)H2O=TiO2xH2O↓+4HCl
①安全漏斗在本实验中的作用除加水外,还有___________。
②根据上述数据计算该产品的纯度为__________。(用含w、c和V的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界上最早发现并使用锌的是中国,明朝末年《天工开物》一书中有世界上最早的关于炼锌技术的记载。回答下列问题:
(1)基态Zn原子的核外电子所占据的最高能层符号为___。
(2)硫酸锌溶于过量的氨水可形成[Zn(NH3)4]SO4溶液。
①[Zn(NH3)4]SO4中阴离子的空间构型为_______。
②![]() 中,中心原子的轨道杂化类型为________。
中,中心原子的轨道杂化类型为________。
③写出一种与![]() 互为等电子体的分子的化学式:________。
互为等电子体的分子的化学式:________。
④NH3极易溶于水,除因为它们都是极性分子外,还因为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学设计实验制备亚氯酸钠![]() 并对其性质进行研究。
并对其性质进行研究。
实验Ⅰ:制取![]()
利用如图所示装置进行实验。

![]() 仪器a的名称是________,其作用是________。
仪器a的名称是________,其作用是________。
![]() 装置
装置![]() 发生的反应中氧化剂和还原剂的物质的量之比为________。
发生的反应中氧化剂和还原剂的物质的量之比为________。
![]() 装置
装置![]() 中制备
中制备![]() 的离子方程式为________。
的离子方程式为________。
![]() 用电解
用电解![]() 和
和![]() 的混合溶液也可以制备
的混合溶液也可以制备![]() ,阴极的电极反应式为________。
,阴极的电极反应式为________。
实验Ⅱ:研究![]() 的性质
的性质
![]() 利用所提供的试剂
利用所提供的试剂![]() 样品、
样品、![]() 溶液、KI溶液、稀硫酸、稀硝酸
溶液、KI溶液、稀硫酸、稀硝酸![]() 验证
验证![]() 的氧化性,并测定
的氧化性,并测定![]() 样品的纯度。
样品的纯度。
![]() 准确称取所得
准确称取所得![]() 样品
样品![]() 于烧杯中,加入适量蒸馏水和过量的________,再滴入适量的________,充分反应,反应的离子方程式为________。将所得混合液配成
于烧杯中,加入适量蒸馏水和过量的________,再滴入适量的________,充分反应,反应的离子方程式为________。将所得混合液配成![]() 待测溶液。
待测溶液。
![]() 移取
移取![]() 待测溶液于锥形瓶中,加几滴淀粉溶液,用
待测溶液于锥形瓶中,加几滴淀粉溶液,用![]() 标准液滴定,至滴定终点。重复2次,测得消耗标准液的平均体积为
标准液滴定,至滴定终点。重复2次,测得消耗标准液的平均体积为![]() 已知:
已知:![]() 。该样品中
。该样品中![]() 的质量分数为________
的质量分数为________![]() 保留一位小数
保留一位小数![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组利用二氧化氯![]() 制备消毒剂、漂白剂亚氯酸钠
制备消毒剂、漂白剂亚氯酸钠![]() ,有关反应原理:
,有关反应原理:![]() 放热反应
放热反应![]()
实验一、制备![]() 晶体
晶体
选择如图所示装置设计实验制备亚氯酸钠晶体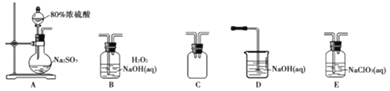
已知:饱和![]() 溶液析出晶体与度关系如下表所示:
溶液析出晶体与度关系如下表所示:
温度 |
|
|
|
品体成分 |
|
|
|
⑴装置连接顺序:![]() ______
______
⑵C装置的作用是______D装置作用是______
⑶A装置中选择![]() 浓硫酸的理由是______
浓硫酸的理由是______
⑷写出E装置中发生反应的离子方程式______
⑸对B装置中溶液采用结晶法提取无水亚氯酸钠晶体,操作分别为蒸发结晶、趁热过滤、用![]() 左右热水洗涤、低于
左右热水洗涤、低于![]() 条件下干燥,得到成品,蒸发结晶时控制温度为______
条件下干燥,得到成品,蒸发结晶时控制温度为______
实验二、测定产品纯度
⑹准确称量/span>ag产品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生反应:![]() ,将所得混合溶液稀释成250mL待测液。取
,将所得混合溶液稀释成250mL待测液。取![]() 待测液于锥形瓶,加入淀粉溶液作指示剂,用
待测液于锥形瓶,加入淀粉溶液作指示剂,用![]() 标准
标准![]() 溶液滴定至终点,测得消耗
溶液滴定至终点,测得消耗![]() 标准溶液的体积为
标准溶液的体积为![]() (已知:
(已知:![]() )
)
![]() 该产品纯度为______(只要求列出计算式)
该产品纯度为______(只要求列出计算式)
![]() 若滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失,则测得结果______(填“偏高偏低”或“无影响”)
若滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失,则测得结果______(填“偏高偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为基本原料可制备许多物质,如:
![]()
下列有关说法正确的是( )。
A.淀粉与纤维素互为同分异构体
B.反应⑤是取代反应
C.反应①是氧化反应
D.在加热条件下,可用银氨溶液鉴别葡萄糖和乙醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com