
| A. | 放电过程是电能转化为化学能的过程 | |
| B. | 充电时阳极反应:Ni(OH)2-e-+OH-═NiOOH+H2O | |
| C. | 放电时正极极附近溶液的pH变小 | |
| D. | 放电时电解质溶液中的OH-向正极移动 |
分析 该电池放电时,化学能转化为电能,充电时电能转化为化学能,放电时负极反应式为Cd-2e-+2OH-=Cd(OH)2、正极反应式为NiOOH+e-+H2O═Ni(OH)2+OH-,充电时阳极上发生的电极反应式为:Ni(OH)2+OH--e-→NiOOH+H2O,阴极上发生的电极反应式为:Cd(OH)2+2e-═Cd+2OH-,据此分析解答.
解答 解:A.放电时,该装置是原电池,是将化学能能转化为电能的过程,故A错误;
B.充电时,阳极上失电子发生氧化反应,电极反应式为Ni(OH)2-e-+OH-=NiOOH+H2O,故B正确;
C.放电时,正极反应式为NiOOH+e-+H2O═Ni(OH)2+OH-,正极上生成氢氧根离子,溶液的pH增大,故C错误;
D,放电时,阴离子向负极移动,则电解质溶液中氢氧根离子向负极Cd移动,故D错误;
故选B.
点评 本题考查原电池和电解池原理,明确各个电极上发生的反应是解本题关键,电极反应式的书写是学习难点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | CH4 C2H4 C3H4 | B. | C2H6C3H6 C4H6 | C. | CH4 C2H6 C3H8 | D. | C2H4 C2H6 C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合溶液中c(K+)为2mol•L-1 | B. | 上述电解过程中共转移2mol电子 | ||
| C. | 电解得到铜的物质的量为0.5mol | D. | 电解后溶液中c(H+)为2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
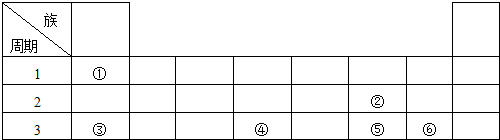
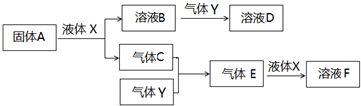
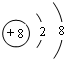 .
.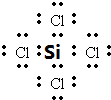 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C与D形成的化合物中只有离子键 | |
| B. | 由C、D、E三元素形成的化合物与A、C、E三元素形成的化合物可能反应 | |
| C. | A、B、C形成的化合物一定不能发生水解反应 | |
| D. | E的氧化物对应的水化物一定为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
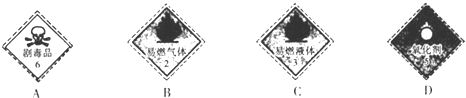
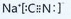 .
.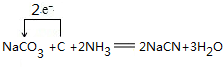 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2-和${NH}_{2}^{-}$ | B. | H3O+和ClO3- | C. | NO3-和CH3+ | D. | PO43-和SO42-. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
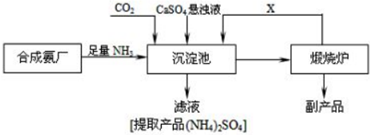
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
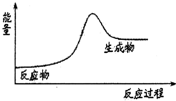
| A. | H2在Cl2中燃烧 | B. | Ba(OH)2•8H2O和NH4Cl固体的反应 | ||
| C. | Na和H2O的反应 | D. | 生石灰溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com