

| 0.002mol |
| 0.2L |
| 2.2×10-20 |
| (10-3)2 |
| 4.0×10-38 |
| (10-3)3 |
| c(NH+4)?c(OH-) |
| c(NH3?H2O) |
| n |
| V |
| c(NH4+)?c(OH-) |
| Kb |
| ||
| 2.5×10-5 |
| b |
| 200 |
| ||
| a |
| b |
| 200a |
| b |
| 200a |


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

 ) ②能与FeCl3溶液发生显色反应
) ②能与FeCl3溶液发生显色反应查看答案和解析>>
科目:高中化学 来源: 题型:

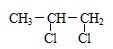 为主要原料(无机试剂任用)制备
为主要原料(无机试剂任用)制备 的合成路线流程图(须注明反应条件)
的合成路线流程图(须注明反应条件)查看答案和解析>>
科目:高中化学 来源: 题型:

| Fe/HC1 |
 有多种同分异构体,写出同分异构体中所有含有1个醛基和2个羟基的芳香族化合物的结构简式
有多种同分异构体,写出同分异构体中所有含有1个醛基和2个羟基的芳香族化合物的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:

 (B2H6为乙硼烷)
(B2H6为乙硼烷)查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

 的合成路线流程图.
的合成路线流程图.| () |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化还原反应的本质是化合价发生变化 |
| B、有单质产生的分解反应一定是氧化还原反应 |
| C、在同一氧化还原反应中,反应物和生成物中都有氧化剂 |
| D、还原剂在反应中失去电子发生还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com