
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


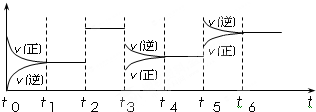
查看答案和解析>>
科目:高中化学 来源: 题型:



| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058
现有下列物质:①NaCl晶体,②液态 ,③NaCl溶液,④Cu,⑤
,③NaCl溶液,④Cu,⑤ 固体,⑥纯蔗糖,⑦酒精,⑧熔融
固体,⑥纯蔗糖,⑦酒精,⑧熔融 ,⑨
,⑨ 气体,⑩
气体,⑩ 固体.
固体.
(1)在题目指定的状态下,以上物质能导电的是____________.
(2)上述物质中属于强电解质的是________________.
(3)上述物质中属于非电解的质是_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:022
现有下列物质:①NaCl晶体,②液态 ,③NaCl溶液,④Cu,⑤
,③NaCl溶液,④Cu,⑤ 固体,⑥纯蔗糖,⑦酒精,⑧熔融
固体,⑥纯蔗糖,⑦酒精,⑧熔融 ,⑨
,⑨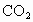 气体,⑩
气体,⑩ 固体.
固体.
(1)在题目指定的状态下,以上物质能导电的是____________.
(2)上述物质中属于强电解质的是________________.
(3)上述物质中属于非电解的质是_______________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com