
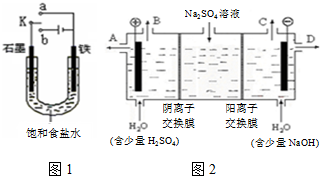
 2OH-+H2↑+Cl2↑;.
2OH-+H2↑+Cl2↑;.分析 (1)①若开始时开关K与a连接,该装置构成原电池,发生电化学腐蚀中的吸氧腐蚀,正极上氧气发生还原反应;
②若开始时开关K与b连接时,两极均有气体产生,则Fe作阴极,石墨作阳极,阳极上氯离子放电、阴极上氢离子放电;
(2)①电解时,溶液中的氢离子的放电能力大于钠离子的放电能力,阴极上得电子发生还原反应;根据阴阳离子的移动方向,通过相同电量时,阴阳离子交换的个数判断;
②阴极上氢离子放电,则NaOH在阴极生成;
③氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,负极上氢气失去电子;结合燃烧热方程式及电池反应计算.
解答 解:(1)①开关K与a连接,为原电池,NaCl溶液为中性,发生吸氧腐蚀,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+2H2O=4OH-,
故答案为:吸氧;
②K与b连接,为电解池,若开始时开关K与b连接时,两极均有气体产生,则Fe作阴极,石墨作阳极,氯离子、氢离子放电,则N为电源负极,电解的总离子反应为2Cl-+2H2O 2OH-+H2↑+Cl2↑,
2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;
(2)①电解时,溶液中的氢离子的放电能力大于钠离子的放电能力,所以阴极上氢离子得电子生成氢气,阴极电极反应为2H++2e-=H2↑;阳极氢氧根离子放电,因此硫酸根离子向阳极移动,阴极氢离子放电,因此钠离子向阴极移动,所以通过相同电量时,通过阳离子交换膜的离子数大于通过阴离子交换膜的离子数,
故答案为:2H++2e-=H2↑;大于;
②阴极上氢离子放电,则NaOH在阴极生成,由图可知,D在阴极附近,制得的氢氧化钠溶液从D出口导出,
故答案为:D;
③氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,负极上氢气失去电子,负极反应式为H2-2e-+2OH-=2H2O,
H2的燃烧热为285.8kJ/mol,则2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol,该燃料电池工作产生27g H2O,n(H2O)=27/18=1.5mol,由燃烧的热方程式可知,生成1.5molH2O放出428.7kJ的热量,即理论上有428.7kJ的能量转化为电能,
故答案为:O2+4e-+2H2O=4OH-;428.7.
点评 本题考查了原电池和电解池原理,为高频考点,注意装置的判断及燃料原电池电极反应式和电解反应的书写,把握电解质溶液的酸碱性确定生成的离子或物质,题目难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
| A. | (3a+0.5b)mol | B. | (3a+0.5b)mol | C. | (3a+0.5b+3p)mol | D. | (3a+0.5b-3p)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ③④ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| B. | 氢气的燃烧热为285.5 kJ•mol-1,则水分解的热化学方程式2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| C. | 已知稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,则浓硫酸与稀NaOH溶液反应生成1 mol水时放出的热量为57.3 kJ | |
| D. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)=FeS(s)△H=-95.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
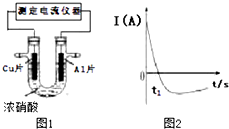 常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(如图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,已知0-t1时,原电池的负极是Al片,反应过程中有红棕色气体产生.下列说法不正确的是( )
常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(如图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,已知0-t1时,原电池的负极是Al片,反应过程中有红棕色气体产生.下列说法不正确的是( )| A. | 0-t1时,正极的电极反应式为:2H++NO3--e-═NO2+H2O | |
| B. | 0-t1时,溶液中的H+向Cu电极移动 | |
| C. | t1时,负极的电极反应式为:Cu-2e-═Cu2+ | |
| D. | t1时,原电池中电子流动方向发生改变是因为Al在浓硝酸中钝化,氧化膜阻碍了Al的进一步反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{A}$(A-N)mol | B. | $\frac{a}{A+2m}$(A-N+m)mol | C. | $\frac{a}{A+2m}$(A-N)mol | D. | $\frac{a}{A+m}$(A-N+m)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑥ | B. | 全部 | C. | ①②③⑥⑦ | D. | ②③④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
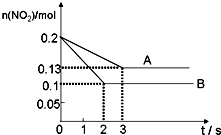 在容积为VL的密闭容器中发生反应:2NO2(g)?2NO(g)+O2(g).反应过程中NO2的物质的量随时间变化的情况如图所示.曲线A和B表示的是该反应在不同条件下的反应状况,则该不同条件是( )
在容积为VL的密闭容器中发生反应:2NO2(g)?2NO(g)+O2(g).反应过程中NO2的物质的量随时间变化的情况如图所示.曲线A和B表示的是该反应在不同条件下的反应状况,则该不同条件是( )| A. | 起始浓度不同 | B. | 有、无催化剂 | C. | 温度不同 | D. | 压强不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com