
| A. | 将二氧化硫通入品红溶液,溶液显红色,加热后变为无色 | |
| B. | 向溶液中加入新制氯水,再滴加KSCN溶液,若溶液变红,则证明原溶液中一定含有Fe2+ | |
| C. | 将湿润的红纸条放进盛有氯气的集气瓶中,红纸条褪色 | |
| D. | 向酸性高锰酸钾溶液中滴加Na2SO3溶液,溶液无明显变化 |
分析 A.二氧化硫具有漂白性,使品红溶液红色褪去;
B.原溶液中含有Fe3+,滴加KSCN溶液,溶液也变红;
C.氯气与水反应生成HClO,HClO具有漂白性;
D.酸性高锰酸钾溶液具有强氧化性,可以氧化亚硫酸钠,溶液颜色褪去.
解答 解:A.二氧化硫具有漂白性,通入品红溶液生成不稳定的无色化合物,溶液红色褪去,再加热,无色溶液又恢复红色,故A错误;
B.原溶液中含有Fe3+,先滴加氯水,再滴加KSCN溶液,溶液也变红,不能证明原溶液中一定含有Fe2+,应先滴加KSCN溶液,溶液不变红,再滴加氯水,溶液变红,说明含有Fe2+,故B错误;
C.氯气与水反应生成HClO,HClO具有强氧化性,可以漂白有色物质,使湿润的红纸条褪色,故C正确;
D.亚硫酸钠具有较强的还原性,酸性高锰酸钾溶液具有强氧化性,可以氧化亚硫酸钠,酸性高锰酸钾溶液颜色褪去,故D错误,
故选:C.
点评 本题考查物质的漂白性、亚铁离子检验、氧化还原反应等,注意中学常见漂白原理:物理吸附、强氧化性、化合型,注意对基础知识的理解掌握.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1 | B. | 0.1mol•L-1 | C. | 0.3mol•L-1 | D. | 3.0mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图a中,随着电解的进行,溶液中c(H+)增大 | |
| B. | 图b中,Mg电极做电池负极 | |
| C. | 图c中,发生的反应为Co+Cd2+=Cd+Co2+ | |
| D. | 图d中,K分别与M、N连接,Fe电极均受到保护 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ Mg2+ I- SO32- | B. | Mg2+ Na+ CO32- I- | ||
| C. | Al3+Na+ SO32- I- | D. | Na+ CO32- Br-I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X中一定不存在FeO | |
| B. | Y中一定含有MnO2,Fe2O3 | |
| C. | Z溶液中一定含有Na2SO4,不能确定是否含有AlCl3 | |
| D. | 不溶物Y中一定含有Fe和CuO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +NaOH→
+NaOH→ +CH3OH.
+CH3OH. ,化合物Ⅳ通过消去反应生成化合物I的化学方程式为
,化合物Ⅳ通过消去反应生成化合物I的化学方程式为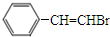 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaBr+H2O(注明反应条件).
+NaBr+H2O(注明反应条件).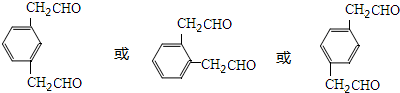
 单体的结构简式为
单体的结构简式为
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com