
| A. | 推广使用燃煤脱硫技术,在燃煤中加入适量石灰石,可减少废气中的SO2 | |
| B. | 实施绿化工程,防治扬尘污染 | |
| C. | 研制开发燃料电池汽车,消除机动车尾气污染 | |
| D. | 加高工厂的烟囱,使烟尘和废气远离地表 |
分析 A.石灰石分解生成氧化钙和二氧化碳,氧化钙和二氧化硫反应生成亚硫酸钙,能起到固硫的作用;
B.植树造林,能够吸收灰尘;
C.化石燃料的燃烧能够产生大量的污染气体;
D.加高工厂烟囱,不会减少向大气中排放废气.
解答 解:A.煤中含有S元素,向煤中加入适量的CaCO3(或CaO),高温下石灰石分解生成CaO,可与SO2以及氧气反应生成硫酸钙,可以大大减少燃物产物中SO2的量,能有效防止大气污染,故A正确;
B.实施绿化工程,防治扬尘污染,故B正确;
C.研制开发燃料电池汽车,能够减少化石燃料的燃烧,消除机动车尾气污染,故C正确;
D.加高工厂烟囱,不会减少向大气中排放废气,与改善生态环境无关,故D错误;
故选:D.
点评 本题考查了环境污染与治理,熟悉空气污染的途径、治理的方法是解题关键,能培养学生树立环保意识.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:选择题
 X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )| A. | Z单质与氢气反应较Y剧烈 | |
| B. | 最高价氧化物对应水化物酸性W比Z强 | |
| C. | X单质氧化性强于Y单质 | |
| D. | X与W的原子核外电子数相差9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①②③⑤⑥⑦ | C. | ①②④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
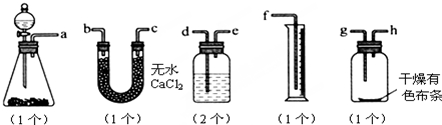
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青苹果只含淀粉不含糖类 | B. | 熟苹果中只含葡萄糖不含淀粉 | ||
| C. | 苹果转熟时葡萄糖合成淀粉 | D. | 苹果转熟时淀粉水解为葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
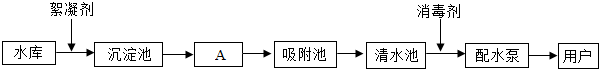
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com