
| A. | 78g过氧化钠晶体中,含2NA个阴离子 | |
| B. | 常温常压下,22.4L氦气含有NA个氦原子 | |
| C. | 在H2O2参与的反应中,1 mol H2O2得到或失去的电子数一定是2NA | |
| D. | 常温下16g O2与O3的混合气体中含氧原子数为NA |
分析 A.1mol过氧化钠含NA个阴离子;
B.常温常压下,气体摩尔体积大于22.4L/mol;
C.H2O2分解生成水和氧气;
D.氧气和臭氧均由氧原子构成.
解答 解:A.78g过氧化钠的物质的量为1mol,1mol过氧化钠含NA个阴离子,故A错误;
B.常温常压下,气体摩尔体积大于22.4L/mol,故22.4L氦气的物质的量小于1mol,则含有的氦原子小于NA个,故B错误;
C.H2O2分解生成水和氧气,1 mol H2O2转移电子数为NA,故C错误;
D.氧气和臭氧均由氧原子构成,故16g混合物中含有的氧原子的物质的量为1mol,个数为NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| W | 其单质既能跟酸反应,又能跟碱反应,都产生H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
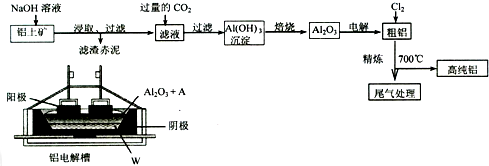
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3,4-二甲基-4-乙基庚烷 | B. | 3,5-二甲基-3-庚烯 | ||
| C. | 3-乙基-1-辛烯 | D. | 2,4,4-三甲基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H++HS-,HS-
H++HS-,HS- H++S2-;
H++S2-;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气在常温下是气体,而磷单质是固体 | |
| B. | N2在空气中不能燃烧,而磷能在空气中燃烧 | |
| C. | NH3极易溶于水,而PH3难溶于水 | |
| D. | 硝酸比磷酸酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
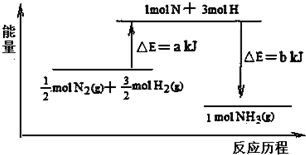
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com