
| A. | 33% | B. | 40% | C. | 50% | D. | 67% |
分析 假设X和Y起始物质的量均为1mol,达平衡时消耗Y物质的量为nmol,利用三段式用m表示出平衡时各各组分的物质的量,根据到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2列方程计算n的值,再根据转化率定义计算.
解答 解:假设X和Y物质的量为1mol,达平衡时消耗Y物质的量为nmol,则:
X(g)+2Y(g)?2Z(g)
起始量(mol):1 1 0
变化量(mol):0.5n n n
平衡量(mol):1-0.5n 1-n n
平衡后测得混合气体中反应物的总物质的量与成物的总物质的量之比为3:2,则:(1-0.5n+1-n):n=3:2,
解得:n=$\frac{2}{3}$,
Y的转化率为:$\frac{\frac{2}{3}mol}{1mol}$×100%≈67%,
故选D.
点评 本题化学平衡的有关计算,题目难度中等,明确三段式在化学平衡的计算方法为解答关键,试题培养了学生的分析、理解能力及化学计算能力.


 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子通式为CnH2n+2的两烷烃一定互为同系物 | |
| B. | 卤代烃发生水解反应一定生成醇 | |
| C. | 苯和甲苯都能被酸性KMnO4溶液氧化 | |
| D. | 烃类都能燃烧生成CO2和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 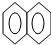 +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$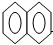 -NO2+H2O -NO2+H2O | |
| B. | CH3CH2CH2CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH2CH=CHCH3+H2O | |
| C. | CH3CHO+H2$→_{催化剂}^{高温高压}$CH3CH2OH | |
| D. | (CH3)2CHCH=CH2+HI→(CH3)2CHCHICH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 0.3 mol/L 的HCl 和50 mL 0.3 mol/L 的NaOH相混合 | |
| B. | 80mL 0.3 mol/L 的HCl 和80 mL 0.3 mol/L 的NaOH溶液相混合 | |
| C. | 80mL 0.3 mol/L 的H2SO4 和80 mL 0.3 mol/L 的NaOH溶液相混合 | |
| D. | 50mL 0.3 mol/L 的H2SO4 和50 mL 0.6 mol/L 的NaOH溶液相混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥⑦ | B. | ③⑤⑦ | C. | ③⑥⑦ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
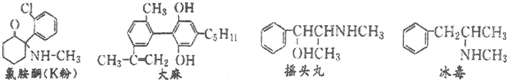
| A. | 四种毒品中都含有苯环,都属于芳香烃 | |
| B. | K粉的化学式为C13H15ONCl | |
| C. | 摇头丸经过消去反应、加成反应可制取冰毒 | |
| D. | 1mol大麻与溴水反应最多消耗4molBr2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
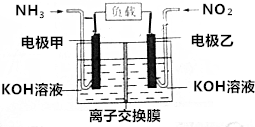 人民网北京2015年12月1日电,为了应对持续的雾霾天气,京津冀区域多个城市迅速启动应急响应,落实应对措施.雾霾成分中含有氮的氧化物,利用反应NO2+NH3→N2+H2O制作如图所示的电池,用以消除氮氧化物的污染.下列有关该电池的说法一定正确的是( )
人民网北京2015年12月1日电,为了应对持续的雾霾天气,京津冀区域多个城市迅速启动应急响应,落实应对措施.雾霾成分中含有氮的氧化物,利用反应NO2+NH3→N2+H2O制作如图所示的电池,用以消除氮氧化物的污染.下列有关该电池的说法一定正确的是( )| A. | 电极乙为电池负极 | |
| B. | 离子交换膜为质子交换膜 | |
| C. | 负极反应式为2NH3-6e-+6OH-═N2+6H2O | |
| D. | 28.0L(标准状况)NO2完全处理,转移5mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.5 | 1.7 | 2.3 | 3.0 | 0.8 |
| 微粒 | BeCl2 | H2S | NH3 | CO32- | BF3 |
| 中心原子杂化方式 | |||||
| 微粒的空间构型 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com