
下列有关元素的性质及其递变规律正确的是( )
|
| A. | ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 |
|
| B. | 第二周期元素从左到右,最高正价从+1递增到+7 |
|
| C. | 同主族元素的简单阴离子还原性越强,水解程度越大 |
|
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
| 元素周期律和元素周期表的综合应用. | |
| 专题: | 元素周期律与元素周期表专题. |
| 分析: | A.ⅠA族为H和碱金属,ⅦA族元素为非金属元素; B.第二周期元素中,O、F没有正价; C.同主族元素的简单阴离子还原性越强,越难水解; D.同周期金属元素的化合价越高,越难失去电子. |
| 解答: | 解:A.ⅠA族为H和碱金属,ⅦA族元素为非金属元素,H与卤族元素形成共价化合物,碱金属元素与卤族元素形成离子化合物,故A正确; B.第二周期元素中,O、F没有正价,则第二周期元素从左到右,最高正价从+1递增到+5,故B错误; C.同主族元素的简单阴离子还原性越强,越难水解,如卤族元素中,碘离子还原性最强,不水解,故C错误; D.同周期金属元素的化合价越高,越难失去电子,如第三周期中,Na比Al容易失去电子,故D错误; 故选A. |
| 点评: | 本题考查元素周期表和元素周期律的应用,注意同周期、同主族元素的性质变化规律是解答本题的关键,注意利用实例分析问题,题目难度中等. |


科目:高中化学 来源: 题型:
饮用水中的NO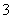 对人类健康会产生危害,为了降低饮用水中NO
对人类健康会产生危害,为了降低饮用水中NO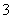 的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO
的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO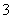 还原为N2,其化学方程式为:Al + NaNO3 + NaOH — NaAlO2 + N2↑+ H2O (未配平)。请回答下列问题:
还原为N2,其化学方程式为:Al + NaNO3 + NaOH — NaAlO2 + N2↑+ H2O (未配平)。请回答下列问题:
(1)上述反应中,________元素的化合价升高,则该元素的原子________(填“得到”或“失去”)电子;而________元素的化合价降低,则该元素的原子被________(填“氧化”或“还原”)。
(2)配平上述反应:
Al + NaNO3 + NaOH = NaAlO2 + N2↑+ H2O
(3)用“双线桥法”表示反应中电子转移的方向和数目:
___________________________________________________________。
(4)上述反应中若标准状况下产生11.2 L气体物质,则转移电子的数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
丙二酸(H2A)的pKa1 = 2.86,pKa2 = 5.70,向20.00 mL Na2A、NaHA混合溶液中加入1.00 mL 0.0100 mol·L-1 HCl,pH为5.70;滴入同样浓度10.00 mL HCI,pH为4.28,求初始混合液中Na2A、NaHA浓度和pH。
查看答案和解析>>
科目:高中化学 来源: 题型:
在碱性溶液中能大量共存且为无色透明的溶液是( )
|
| A. | K+、Cl﹣、MnO4﹣、SO42﹣ | B. | Na+、Cu2+、NO3﹣、CO32﹣ |
|
| C. | Na+、NO3﹣、SO42﹣、HCO3﹣ | D. | Na+、SO42﹣、Cl﹣、NO3﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
以下有关原子结构及元素周期律的叙述正确的是( )
|
| A. | 第IA族元素铯的两种同位素137Cs比133Cs多4个质子 |
|
| B. | 同周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
|
| C. | 第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 |
|
| D. | 同主族元素从上到下,单质的熔点逐渐降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.
请回答下列问题:
(1)T的原子结构示意图为 .
(2)元素的非金属性为(原子的得电子能力):Q W(填“强于”或“弱于”).
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 .
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 .
(5)R有多种氧化物,其中甲的相对分子质量最小.在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是 .
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量akJ和bkJ.又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的△H= (注:题中所涉单质均为最稳定单质).

查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式正确的是 ( )
A.FeCl3溶液腐蚀铜板电路:Fe3++Cu=Fe2++Cu2+
B.碳酸钙溶于醋酸溶液:CaCO3+2H+=Ca2++CO2↑+H2O
C.铜与稀硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
D.Ba(OH)2溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值.下列说法正确的是( )
|
| A. | 标准状况下,40g SO3的体积为11.2L |
|
| B. | 高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3 NA |
|
| C. | 5NH4NO3 |
|
| D. | 56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是
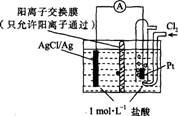
A.正极反应为AgCl+e-═Ag+Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com