
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
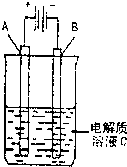 (2011?太原二模)现已确认,CO、SO2和NOx的排放是造成大气污染的重要原因.
(2011?太原二模)现已确认,CO、SO2和NOx的排放是造成大气污染的重要原因.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:太原二模 题型:问答题
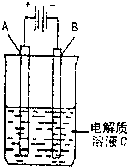
查看答案和解析>>
科目:高中化学 来源: 题型:
A.等质量的铜分别和过量的浓硫酸、浓硝酸充分反应,则反应过程中转移的电子数之比为1∶1
B.元素的非金属性越强,其最高价氧化物对应水化物的酸性、氧化性也越强
C.已知C和CO的燃烧热分别为Q1、Q2 kJ·mol-1,则1 mol C与0.5 mol O2完全反应生成(相同条件下)CO时的ΔH为(Q2-Q1) kJ·mol-1
D.凡有单质参加或生成的化学反应一定属于氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com