
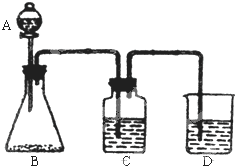
 为了确定
为了确定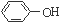 是一种弱酸,有人设计了如图所示的装置进行实验:
是一种弱酸,有人设计了如图所示的装置进行实验:分析 ①A的仪器是分液漏斗;
②B中药品为正盐,为了检验苯酚的弱酸性,利用强酸制取弱酸的方法判断,醋酸酸性>碳酸酸性>苯酚酸性,所有可以用醋酸和碳酸钠反应生成二氧化碳,然后用二氧化碳和苯酚钠溶液反应生成苯酚;
③醋酸具有挥发性,醋酸也能和苯酚钠反应,则应该先除去醋酸,然后用二氧化碳和苯酚钠溶液反应;
④二氧化碳和苯酚钠溶液反应生成苯酚和碳酸氢钠.
解答 解:①A仪器名称是分液漏斗,故答案为:分液漏斗;
②B中药品为正盐,为了检验苯酚的弱酸性,利用强酸制取弱酸的方法判断,醋酸酸性>碳酸酸性>苯酚酸性,所有可以用醋酸和碳酸钠反应生成二氧化碳,然后用二氧化碳和苯酚钠溶液反应生成苯酚,所以B中药品是碳酸钠,发生的离子反应方程式为2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑,故答案为:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑;
③醋酸具有挥发性,醋酸也能和苯酚钠反应,则应该先除去醋酸,然后用二氧化碳和苯酚钠溶液反应,所以C装置的作用是吸收挥发出的乙酸,故答案为:除去CO2中的乙酸;
④二氧化碳和苯酚钠溶液反应生成苯酚和碳酸氢钠,反应方程式为:C6H5ONa+CO2+H2O→C6H6OH+NaHCO3,故答案为:C6H5ONa+CO2+H2O→C6H6OH+NaHCO3.
点评 本题考查性质实验方案设计,为高频考点,明确实验原理、物质性质是解本题关键,侧重考查学生实验设计、实验评价能力,注意:物质性质检验时要排除其它物质的干扰,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 序号 | 实验内容 | 实验目的 |
| A | 测定NaClO溶液,CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向Mg(OH)2浊液中滴加少量0.1mol/LFeCl3溶液 | 比较Mg(OH)2和Fe(OH)3的溶解度 |
| C | 将两个完全相同且充满NO2的密闭烧瓶,分别浸泡于热水、冰水中 | 探究温度对化学平衡状态的影响 |
| D | 向两只同体积同浓度的K2Cr2O7溶液中,分别加入1mL同浓度的H2SO4、NaOH溶液 | 探究浓度对该化学平衡状态的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.02×1023 就是阿佛加德罗常数 | |
| B. | 1 摩尔氢气含有2NA个氢原子 | |
| C. | 1 摩尔任何物质都含有6.02×1023 个分子 | |
| D. | 1 摩尔水含有18×6.02×1023 个分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
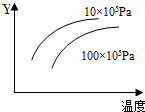 由可逆反应测绘出图象如下,纵坐标Y为生成物在平衡混合物中的体积百分含量,下列对该反应的判断正确的是( )
由可逆反应测绘出图象如下,纵坐标Y为生成物在平衡混合物中的体积百分含量,下列对该反应的判断正确的是( )| A. | 正反应为一定为放热反应 | B. | 逆反应为体积缩小的反应 | ||
| C. | 升高温度,平衡常数K值减小 | D. | 该反应在一定条件下可自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
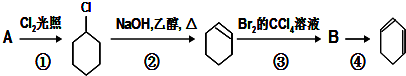
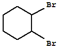 ;
; +Cl2 $\stackrel{光照}{→}$
+Cl2 $\stackrel{光照}{→}$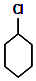 +HCl.
+HCl.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com