
°æƒø°øœ÷”–≤ø∑÷∂Ã÷Ð∆⁄‘™Àÿµƒ–‘÷ ªÚ‘≠◊”Ω·ππ»Á±Ì«“‘≠◊”–Ú ˝∞¥XYTZ“¿¥Œ‘ˆ¥Û£∫
‘™Àÿ±ý∫≈ | ‘™Àÿ–‘÷ ªÚ‘≠◊”Ω·ππ |
X | ◊ÓÕ‚≤„µÁ◊” ˝ «¥ŒÕ‚≤„µÁ◊” ˝µƒ2±∂ |
Y | ≥£Œ¬œ¬µ•÷ Œ™À´‘≠◊”∑÷◊”£¨∆‰«‚ªØŒÔÀƻГ∫≥ ºÓ–‘ |
T | ◊ÓÕ‚≤„µÁ◊” ˝ «µÁ◊”≤„ ˝µƒ2±∂ |
Z | ‘™Àÿ◊Ó∏þ’˝º€ «+7º€ |
£®1£©Àƒ÷÷‘™Àÿ‘≠◊”∞Îæ∂”…¥ÛµΩ–°µƒÀ≥–Ú «£®–¥‘™Àÿ∑˚∫≈£© £Æ
£®2£©‘™ÀÿY”Ϋ‚‘™Àÿ–Œ≥…µƒ“ª÷÷¿Î◊”YH4+ £¨ –¥≥ˆ∏√Œ¢¡£µƒµÁ◊” Ω£®”√‘™Àÿ∑˚∫≈±Ì 棩£Æ
£®3£©T‘™ÀÿµƒºÚµ•“ı¿Î◊”µƒΩ·ππ æ“‚Õº « £¨
£®4£©÷§√˜∏√¡£◊”µƒªπ‘≠–‘±»Z©Å«øµƒ¿Î◊”∑Ω≥Ã Ω « £Æ
£®5£©‘™ÀÿZµƒµ•÷ ”Ϋ‚—ıªØƒ∆»Ð“∫∑¥”¶µƒªØ—ß∑Ω≥Ã ΩŒ™ £Æ
£®6£©Ω´9gµ•÷ X‘⁄◊„¡ø—ı∆¯÷–»º…’£¨À˘µ√∆¯ÃÂÕ®»Î1L 1molL©Å1NaOH»Ð“∫÷–£¨ÕÍ»´Œ¸ ’∫Û£¨Ω´»Ð“∫‘⁄ºı—πµÕŒ¬Ãıº˛œ¬’Ù∏…£¨µ√µΩ≤ª∫¨Ω·æßÀƵƒπÃÃÂ÷ ¡øŒ™g£Æ
°æ¥∞∏°ø
£®1£©S£æCl£æC£æN
£®2£©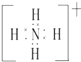
£®3£©
£®4£©Cl2+S2©Å=S+2Cl©Å
£®5£©Cl2+2NaOH=NaCl+NaClO+H2O
£®6£©68.5
°æΩ‚Œˆ°øΩ‚£∫Xµƒ‘≠◊”◊ÓÕ‚≤„µÁ◊” ˝ «¥ŒÕ‚≤„µƒµÁ◊” ˝µƒ2±∂£¨◊ÓÕ‚≤„µÁ◊” ˝≤ªƒÐ≥¨π˝8∏ˆ£¨‘Ú∆‰¥ŒÕ‚≤„ «K≤„£¨◊ÓÕ‚≤„ «L≤„£¨L≤„…œµÁ◊” ˝ «4£¨‘ÚR‘≠◊”∫ÀÕ‚µÁ◊” ˝=2+4=6£¨À˘“‘∏√‘™Àÿ «C‘™Àÿ£ªYµ•÷ «À´‘≠◊”∑÷◊”£¨«“∆‰«‚ªØŒÔÀƻГ∫œ‘ºÓ–‘£¨ø…÷™Y «N‘™Àÿ£ªT‘™Àÿ‘≠◊”µƒ◊ÓÕ‚≤„µÁ◊” ˝ «µÁ◊”≤„ ˝2±∂µƒ‘™Àÿ£¨”…‘≠◊”–Ú ˝πÿœµø…÷™TŒ™S‘™Àÿ£ªZµƒ◊Ó∏þ’˝º€Œ™+7º€£¨”¶Œ™Cl‘™Àÿ.
£®1.£©Õ¨÷Ð∆⁄◊‘◊Û∂¯”“‘≠◊”∞Îæ∂ºı–°£¨Õ¨÷˜◊Â◊‘…œ∂¯œ¬‘≠◊”∞Îæ∂‘ˆ¥Û£¨π ‘≠◊”∞Îæ∂S£æCl£æC£æN£¨À˘“‘¥∞∏ «£∫S£æCl£æC£æN£ª
£®2.£©YH4+Œ™Ôß∏˘¿Î◊”£¨µÁ◊” ΩŒ™ 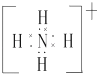 £¨À˘“‘¥∞∏ «£∫
£¨À˘“‘¥∞∏ «£∫  £ª
£ª
£®3.£©¡Ú¿Î◊”∫ÀÕ‚”–3∏ˆµÁ◊”≤„£¨◊ÓÕ‚≤„µÁ◊” ˝Œ™8£¨Ω·ππ æ“‚ÕºŒ™  £¨
£¨
À˘“‘¥∞∏ «£∫  £ª
£ª
£®4.£©∑«Ω Ùµƒ∑«Ω Ù–‘‘Ω«ø£¨∆‰ºÚµ•“ı¿Î◊”µƒªπ‘≠–‘‘Ω»ı£¨∆‰µ•÷ µƒ—ıªØ–‘‘Ω«ø£¨¡Ú¿Î◊”ƒÐªπ‘≠¬»∆¯…˙≥…¬»¿Î◊”£¨À˘“‘¡Ú¿Î◊”ªπ‘≠–‘¥Û”⁄¬»¿Î◊”£¨¿Î◊”∑Ω≥Ã ΩŒ™Cl2+S2©Å=S+2Cl©ÅÀ˘“‘¥∞∏ «£∫Cl2+S2©Å=S+2Cl©Å£ª
£®5.£©¬»∆¯”Ϋ‚—ıªØƒ∆»Ð“∫∑¥”¶…˙≥…¬»ªØƒ∆∫Õ¥Œ¬»À·ƒ∆£¨∑Ω≥Ã ΩŒ™Cl2+2NaOH=NaCl+NaClO+H2O£¨À˘“‘¥∞∏ «£∫Cl2+2NaOH=NaCl+NaClO+H2O£ª
£®6.£©n£®C£©= ![]() =0.75mol£¨n£®NaOH£©=1L°¡1molL©Å1=1mol£¨∂˛’þ∑¢…˙3CO2+4NaOH=Na2CO3+2NaHCO3+2H2O£¨”…∑Ω≥à Ωø…÷™…˙≥…0.25molNa2CO3°¢0.5molNaHCO3 £¨ ÷ ¡øŒ™0.25mol°¡106g/mol+0.5mol°¡84g/mol=68.5g£ÆÀ˘“‘¥∞∏ «£∫68.5£Æ
=0.75mol£¨n£®NaOH£©=1L°¡1molL©Å1=1mol£¨∂˛’þ∑¢…˙3CO2+4NaOH=Na2CO3+2NaHCO3+2H2O£¨”…∑Ω≥à Ωø…÷™…˙≥…0.25molNa2CO3°¢0.5molNaHCO3 £¨ ÷ ¡øŒ™0.25mol°¡106g/mol+0.5mol°¡84g/mol=68.5g£ÆÀ˘“‘¥∞∏ «£∫68.5£Æ


 «·À… ÓºŸ◊Ð∏¥œ∞œµ¡–¥∞∏
«·À… ÓºŸ◊Ð∏¥œ∞œµ¡–¥∞∏
| ƒÍº∂ | ∏þ÷–øŒ≥à | ƒÍº∂ | ≥ı÷–øŒ≥à |
| ∏þ“ª | ∏þ“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı“ª | ≥ı“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ∂˛ | ∏þ∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı∂˛ | ≥ı∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ»˝ | ∏þ»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı»˝ | ≥ı»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° |
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øª∑æ≥Œ€»æ“—≥…Œ™»À¿ý…Áª·√Ê¡Ÿµƒ÷ÿ¥ÛÕ˛–≤£¨∏˜÷÷Œ€»æ ˝≤ª § ˝£¨œ¬¡–√˚¥ ”Ϊ∑æ≥Œ€»æŒÞπÿµƒ «( )
¢ŸŒ¬ “–ß”¶ ¢⁄≥ý≥± ¢€À·”Í ¢Ðπ‚ªØ—ߌ€»æ ¢ð≥Ù—ı≤„ø’∂¥ ¢ÞÀÆŸ∂≤° ¢þ≥±œ´ ¢ý¥Û≤±◊”≤°
A.¢Ÿ¢⁄
B.¢þ¢ý
C.¢Þ¢þ¢ý
D.¢⁄¢ð¢þ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øº∫÷™∆œÃ—ëµƒΩ·ππºÚ ΩŒ™CH2OH£®CHOH£©4CHO£¨”…¥À≈–∂œœ¬¡–πÿ”⁄∆œÃ—ë–‘÷ µƒ– ˆ÷–≤ª’˝»∑µƒ «£® £©
A.∆œÃ—ëƒÐ∑¢…˙ı•ªØ∑¥”¶
B.∆œÃ—ëæþ”–ªπ‘≠–‘
C.∆œÃ—ë≥‰∑÷»º…’µƒ≤˙ŒÔŒ™CO2”ÎH2O
D.ÕÍ»´»º…’µ»÷ ¡øµƒ∆œÃ—ë∫Õº◊»©£¨À˘–Ë—ı∆¯ŒÔ÷ µƒ¡ø≤ªœýÕ¨
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø£®1£©–¥≥ˆœ¬¡–ŒÔ÷ ‘⁄ÀÆ÷–µƒµÁ¿Î∑Ω≥à Ω
úÀ·«‚ƒ∆______________________________________________________________°£
—«¡ÚÀ·________________________________£¨______________________________°£
£®2£©“—÷™25 °Ê ±”–πÿ»ıÀ·µƒµÁ¿Î∆Ω∫‚≥£ ˝»Áœ¬£∫HCN:4.9°¡10£≠10£¨H2CO3:K1£Ω4.4°¡10£≠7 K2£Ω4.7°¡10£≠11£¨œÚNaCN»Ð“∫÷–Õ®»Î…Ÿ¡ø∂˛—ıªØú∆¯Ã£¨–¥≥ˆ∑¢…˙∑¥”¶µƒ¿Î◊”∑Ω≥à Ω_____°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø“ª∂®Ãıº˛œ¬Ω´0.1 mol N2∫Õ0.3 mol H2÷√”⁄√б’»ð∆˜÷–∑¢…˙∑¥”¶N2+3H2![]() 2NH3°£œ¬¡–πÿ”⁄∏√∑¥”¶µƒÀµ∑®’˝»∑µƒ «
2NH3°£œ¬¡–πÿ”⁄∏√∑¥”¶µƒÀµ∑®’˝»∑µƒ «
A. ◊Ó÷’ø……˙≥…0.2 mol NH3 B. µ±n(N2):n(H2)=1:3 ±£¨∑¥”¶“ª∂®¥ÔªØ—ß∆Ω∫‚
C. …˝∏þŒ¬∂»∑¥”¶ÀŸ¬ ‘ˆ¥Û D. ‘ˆ¥Û—π«ø∑¥”¶ÀŸ¬ ºı–°
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øœ¬¡–”√∆∑µƒ÷˜“™≥…∑÷≤ª’˝»∑µƒ «
A | B | C | D | |
”√∆∑ | ÀÆ≤£¡ß | °∞84°±œ˚∂æ“∫ | –°À’¥Ú | π‚µºœÀŒ¨ |
÷˜“™≥…∑÷ | Na2SiO3 | NaClO | NaHCO3 | Si |
A. A B. B C. C D. D
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø»ÁÕºA°¢B°¢C»˝∏ˆ…’±≠÷–∑÷± ¢”–œýÕ¨ŒÔ÷ µƒ¡ø≈®∂»µƒœ°¡ÚÀ·£Æ 
£®1£©B÷–Snº´…œ≥ˆœ÷µƒœ÷œÛ
£®2£©C÷–Zn∆¨…œµƒµÁº´∑¥”¶ ΩŒ™£ª
£®3£©A°¢B°¢C÷–Ã˙»ÐΩ‚µƒÀŸ¬ ”…øÏµΩ¬˝µƒÀ≥–Ú «
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øº»ƒÐ∑¢…˙º”≥…∑¥”¶£¨”÷ƒÐ∑¢…˙‘̪Ø∑¥”¶µƒ «( )
A.÷≤ŒÔ”Õ
B.∏ ”Õ
C.”ÕÀ·
D.»Ì÷¨À·
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øƒ≥ªØ—ß–À»§–°◊ȵƒÕ¨—ßÕ®π˝≤È‘ƒ◊ ¡œ£¨ªÒµ√¡À≤ðÀ·µƒ“ª–©–≈œ¢£¨’˚¿Ì≥ˆœ¬±Ì°£
Ω·ππºÚ Ω | HOOC-OOH |
»ÐΩ‚–‘ | ƒÐ»Ð”⁄ÀÆ£¨“◊»Ð”⁄““¥º |
Ãÿ–‘ | ¥Û‘º‘⁄157°Ê…˝ª™(175°Ê“‘…œ∑¢…˙∑÷Ω‚) |
ªØ—ß–‘÷ | H2C2O4+Ca(OH)2=CaC2O4°˝+2H2O |
HOOC-COOH | |
2KMnO4+5H2C2O4+3H2SO4= K2SO4+2MnSO4+10CO2°¸+8H2O |
£®1£©∏√◊ÈÕ¨—ß”˚Õ®π˝ µ—È—È÷§≤ðÀ· л»∑÷Ω‚≤˙ŒÔ÷–µƒCO2∫ÕCO(◊∞÷√∑˚∫œ∆¯√Ж‘“™«Û£¨∆‰À˚ ‘º¡ø…—°)°£

¢ŸÃÓ–¥±Ì÷–ø’ƒ⁄°£
“«∆˜ | A | B | C |
º”»Î ‘º¡ | ________ | ________ | NaOH»Ð“∫ |
¢⁄ºÚ ˆºÏ—ÈCOµƒ µ—È∑Ω∑®∫Õ µ—Èœ÷œÛ__________________°£
£®2£© µ—È “≥£”√≤ðÀ·ƒ∆≤‚∂®KMnO4»Ð“∫µƒ≈®∂»°£
¢Ÿ◊º»∑≥∆»°2.680g≤ðÀ·ƒ∆£¨»Ð”⁄œ°¡ÚÀ·∫ÕÀÆ÷∆≥…100.0 mL»Ð“∫£¨√ø¥Œ»°20.00mL»Ð“∫”⁄◊∂–Œ∆ø÷–£ªΩ´¥˝≤‚KMnO4»Ð“∫÷√”⁄_______________(ÃÓ°∞À· Ω°±ªÚ°∞ºÓ Ω°±)µŒ∂®πÐ÷–Ω¯––µŒ∂®°£÷ÿ∏¥…œ ˆµŒ∂®≤Ÿ◊˜»˝¥Œ£¨ µ—È ˝Èß»Áœ¬±ÌÀ˘ æ°£¥˝≤‚KMnO4»Ð“∫µƒŒÔ÷ µƒ¡ø≈®∂»Œ™____________°£
µŒ∂®«∞æ˘Œ™ | µ⁄“ª¥Œ÷’µ„ | µ⁄∂˛¥Œ÷’µ„ | µ⁄»˝¥Œ÷’µ„ | |
µŒ∂®πГ∫√ÊøÃ∂» | 0.00 mL | 20.02mL | 21.00mL | 19.98mL |
¢⁄Ω´À·–‘KMnO4»Ð“∫∫ÕH2C2O4»Ð“∫ªÏ∫œ∫Û£¨∑¢œ÷ø™ º ±»Ð“∫Õ …´≤ª√˜œ‘£¨µ´≤ªæ√∫Û—∏ÀŸÕ …´£¨’Î∂‘∏√ µ—Èœ÷œÛ£¨ƒ≥Õ¨—ß»œŒ™KMnO4»Ð“∫”ÎH2C2O4»Ð“∫µƒ∑¥”¶ «∑≈»»∑¥”¶£¨µº÷¬»Ð“∫Œ¬∂»…˝∏þ£¨∑¥”¶ÀŸ¬ º”øÏ°£ƒ„≤¬œÎªπ”–ø…ƒÐ «_____________µƒ”∞œÏ°£»Ù”√ µ—È÷§√˜ƒ„µƒ≤¬œÎ£¨≥˝KMnO4»Ð“∫°¢H2C2O4»Ð“∫°¢œ°¡ÚÀ·Õ‚£¨ªπ–Ë“™—°‘Òµƒ∫œ¿Ì ‘º¡ «__________________°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
∞Ÿ∂»÷¬–≈ - ¡∑œ∞≤·¡–±Ì - ‘¡–±Ì
∫˛±± °ª•¡™Õ¯Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®∆Ωî | Õ¯…œ”–∫¶–≈œ¢æŸ±®◊®«¯ | µÁ–≈’©∆≠柱®◊®«¯ | …Ê¿˙ ∑–ÈŒÞ÷˜“”–∫¶–≈œ¢æŸ±®◊®«¯ | …Ê∆Û«÷»®æŸ±®◊®«¯
Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®µÁª∞£∫027-86699610 柱®” œ‰£∫58377363@163.com