
下列说法正确的是( )
A.按分散剂种类可将分散系分为溶液、胶体和浊液
B. 漂白粉、钢、氯水、Fe(OH)3胶体均为混合物
C. CO2、SO3、NO2和水反应均能生成相应的酸,都属于酸性氧化物
D. KNO3溶液、铜、熔融的NaCl均能导电,都属于电解质
科目:高中化学 来源: 题型:
用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。
其中正确的是( )
| 选项 | 气体 | a | b | c | d |
| A | CO2 | 盐酸 | CaCO3 | 饱和Na2CO3 溶液 | 浓硫酸 |
| B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
| C | NH3 | 饱和NH4Cl 溶液 | 消石灰 | H2O | 固体NaOH |
| D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方法或操作不正确的是
A.蒸馏实验中,为了防止暴沸,要在蒸馏烧瓶中加入沸石
B.可用丁达尔效应区别溶液和胶体
C.用CCl4萃取碘水后分液时,先打开分液漏斗活塞,放出下层液体,再关闭活塞,从漏斗
上口倒出上层液体
D.检验某溶液中是否含有Fe2+时,可先加入适量的氯水,再滴加硫氰化钾溶液,若溶液变
为红色,则说明溶液中一定含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学帮助水质检测站配制800mL 1 mol·L-1NaOH溶液备用。
(1)该同学应选择的玻璃仪器除了烧杯、量筒、玻璃棒、胶头滴管外,还有 ▲ 。
(2)其操作步骤如下图所示,则如图操作应在下图中的 ▲ (填选项字母)之间。
A.②与③ B.①与② C.④与⑤ D.③与④
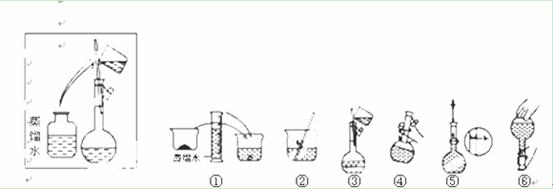
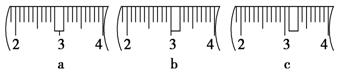 (3)该同学应用托盘天平称取NaOH固体 ▲ g,用质量为33.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在下图中选出能正确表示游码位置的选项 ▲ (填选项字母)。
(3)该同学应用托盘天平称取NaOH固体 ▲ g,用质量为33.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在下图中选出能正确表示游码位置的选项 ▲ (填选项字母)。
(4)下列操作对所配溶液浓度大小有何影响 (填“偏大”、“偏小”或“无影响”)。
①定容时,仰视读数,浓度会 ▲ ;
②转移溶液过程中,未洗涤玻璃棒和烧杯,浓度会 ▲ ;
③容量瓶未干燥,浓度会 ▲ ;
④定容摇匀后发现溶液凹面低于刻度线,继续加水至刻度线,浓度会 ▲ 。
(5)配制溶液的实际操作过程中,动作要快,否则由于 ▲ ,会使配制的NaOH溶液的浓度比1 mol·L-1 __ ▲____(填“大”或“小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列各组离子中能大量共存的是( )
A. K+、ClO-、SO42-、H+ B. K+、H+、NO3-、Fe2+
C. Na+、CO32-、Cl-、Ca2+ D. Na+、Cl-、SO42-、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
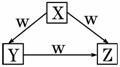
X、Y、Z、W是中学化学常见的四种物质,它们之间具有如图所示转化关系,则下列组合不可能的是( )
| X | Y | Z | W | |
| A | C | CO | CO2 | O2 |
| B | Na | Na2O | Na2O2 | O2 |
| C | AlCl3 | Al(OH)3 | Na[Al(OH)4] | NaOH |
| D | Fe | FeCl2 | FeCl3 | Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个不导热的密闭反应器中,只发生两个反应:
a(g)+b(g)2c(g) Δ H1<0
H1<0
x(g)+3y(g)2z(g) ΔH2>0
进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是( )
A.等压时,通入惰性气体,c的物质的量不变
B.等压时,通入z气体,反应器中温度升高
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入z气体,y的物质的量浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸是强酸,中学阶段将硫酸在水溶液中看做完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为H2SO4===H++HSO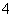 ,HSO
,HSO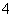 H++SO
H++SO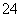 。
。
请回答下列有关问题:
(1)Na2SO4溶液 呈________(填“弱酸性”、“中性”或“弱碱性”),其理由是
呈________(填“弱酸性”、“中性”或“弱碱性”),其理由是
_____________________________________________________________。
(用离子方程式表示)。
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为________
________________________________________________________________________。
(3)在0.10 mol·L-1的Na2SO4溶液中,下列离子浓度的关系正确的是________(填写编号)。
A.c(Na+)=c(SO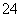 )+c(HSO
)+c(HSO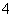 )+c(H2SO4)
)+c(H2SO4)
B.c(OH-)=c(HSO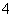 )+c(H+)
)+c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(HSO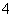 )+2c(SO
)+2c(SO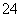 )
)
D.c(Na+)=2c(SO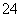 )+2c(HSO
)+2c(HSO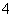 )
)
(4)若25℃时,0.10 mol·L-1的NaHSO4溶液中c(SO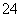 )=0.029 mol·L -1,则0.10 mol·L-1的H2SO4溶液中c(SO
)=0.029 mol·L -1,则0.10 mol·L-1的H2SO4溶液中c(SO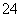 )________0.029 mol·L-1(填“<”、“>”或“=”),其理由是
)________0.029 mol·L-1(填“<”、“>”或“=”),其理由是
________________________________________________________________________
________________________________________________________________________。
(5)或25℃时,0.10 mol·L-1H2SO4溶液的pH=-lg 0.11,则0.10 mol·L-1H2SO4溶液中c(SO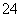 )=________ mol·L-1。
)=________ mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com