
| ,0.85cV |
| 10.00mL×ρg/mL |
| 0.085cV |
| ρ |
| 0.085cV |
| ρ |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
(2009四川绵阳二次诊断,10)目前国家仍允许在面粉中添加过氧化苯甲酰来使面粉增白,但它的安全性已引起公众质疑。已知过氧化苯甲酰能发生如下反应:

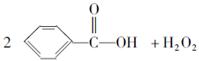
下列叙述不正确的是( )
A.并非在食品中添加任何化学物质都对人体有害
B.过氧化苯甲酰能使面粉增白的原因是它与水反应生成的H2O2具有漂白性
C.苯甲酸的同分异构体中,既属于醛又属于酚的物质有4 种
D.甲苯经两步取代反应和两步催化氧化反应可转化为苯甲酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com