
下列甲、乙、丙、丁各装置中发生的反应,有关说法正确的是
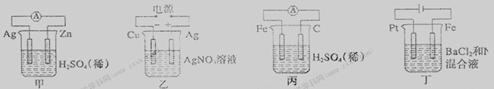
A.甲中负极反应式为2H++2e - =H2↑ B.乙中电解一段时间,溶液的质量会增重
C.丙中H+向碳棒方向移动 D.丁中电解开始时阴极产生黄绿色气体
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
不论以何种比例混合,只要混合物的质量一定,完全燃烧后生成CO2的量也一定的一组物质是( )
A.甲苯和乙苯 B.乙烯和丁烯
C.甲烷和丙烯 D.乙炔和丁炔
查看答案和解析>>
科目:高中化学 来源: 题型:
某烃中碳元素和氢元素的质量比为24∶5,该烃在标准状况下的密度是2.59 g·L-1,则其分子式为( )
A.C2H6 B.C4H10 C.C5H8 D.C7H8
查看答案和解析>>
科目:高中化学 来源: 题型:
氨气是重要的化工原料
(1)已知: N2(g)+O2(g)=2NO(g) △H= +180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H= -905kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H= -483.6kJ·mol-1
写出氨气在高温高压催化剂条件下生成氮气和氢气的热化学方程式: ;如果在1L密闭容器中,3mol NH3 在等温条件下充分反应,2min后达到平衡,平衡时的反应热为92.4kJ ,则在这段时间内v(H2)= ;保持温度不变,将起始NH3的物质的量调整为8mol,平衡时NH3的转化率为 。
(2)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式: ,
科学家利用此原理,设计成氨气一氧气燃料电池,则通入氨气的电极是 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为 。
(3)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
a.增大压强 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
(4)如果某氨水的电离程度为1%,浓度为0.01 mol/LMgCl2溶液滴加氨水至开始产生沉淀时(不考虑溶液体积变化),溶液中的NH3·H2O的浓度为 {已知Ksp[Mg(OH)2]=4.0×10-12]}
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)环境专家认为可以用金属铝将水体中的NO 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH 、Al(OH)3、NO
、Al(OH)3、NO 、N2,写出反应的离子方程式 。
、N2,写出反应的离子方程式 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3。电池正极的电极反应式为 。
(3)已知:①4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol
②Fe2O3(s)+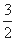 C(s)=
C(s)= 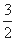 CO2(g)+2Fe(s) △H=+234.1kJ/mol
CO2(g)+2Fe(s) △H=+234.1kJ/mol
③C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式 。
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图: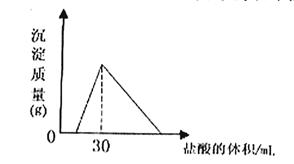 则反应过程中产生氢气的总体积为 L(标准状况)
则反应过程中产生氢气的总体积为 L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的 pH 在 5.0~6.0 之间,通过电解生成 Fe(OH)3 沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成 浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置如图所示: (1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,则无法使悬浮物形成浮渣。
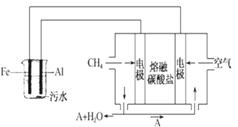
此时,应向污水中加入适量的_________。
a. H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.CH3CH2OH
(2)电解池阳极的电极反应分别是①______________;
②4OH--4e-=2H2O+O2↑
(3)电极反应①和②的生成物反应得到 Fe(OH)3 沉淀的离子方程式是__________。
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以 CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是 CH4+4CO2-8e-===5CO2+2H2O。
①正极的电极反应是______________。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。 则 A 物质的化学式是___________。
(5)实验过程中,若在阴极产生了 44.8L(标准状况)气体,则熔融盐燃料电池消耗 CH4_____L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子反应方程式正确的是( )
A.在硫酸铝溶液中加入过量氨水:Al3+ + 4OH- = AlO2-+2H2O
B.碳酸氢镁溶液中加入过量石灰水:
Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓
C.往FeCl3溶液中加入Fe粉:2Fe3+ +Fe =3Fe2+
D.氧化亚铁溶于稀硝酸:FeO+2H+=Fe2++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,加热等物质的量的NaHCO3和Na2O2的固体混合物,充分反应后,容器中的固体剩余物是( )
A.Na2CO3和Na2O2 B.Na2CO3和NaOH C.NaOH和Na2O2 D.NaOH、Na2O2和Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
3 mol H2和1 mol N2放入密闭容器中,使用催化剂发生反应:N2(g)+3H2(g)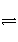
 2NH3(g),从反应开始到平衡过程中,不可能出现的是( )
2NH3(g),从反应开始到平衡过程中,不可能出现的是( )
A.2 mol NH3 B.0.5 mol NH3
C.0.9 mol N2 D.H2和NH3物质的量相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com