
【题目】将饱和氯化铁溶液滴入沸水时,液体变为________色,得到的是________,反应的化学方程式为________________________。用此分散系进行实验:
(1)将其装入U形管内,用石墨作电极,接通直流电源,通电一段时间后发现阴极附近颜色________,这表明____________________,这种现象称为________。
(2)向其中加入饱和的氯化钠溶液,发生的现象是____________。
(3)向其中逐滴加入过量稀硫酸,现象是______________,原因是___________________________。
【答案】红褐色 Fe(OH)3胶体 FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl 逐渐变深 Fe(OH)3胶粒吸附阳离子带电荷 电泳 生成红褐色沉淀 先沉淀后溶解 因为硫酸是电解质,向胶体中加入电解质,首先发生聚沉,得到沉淀,随着加入过量的硫酸,H+与Fe(OH)3发生反应Fe(OH)3+3H+=Fe3++3H2O,使沉淀溶解
Fe(OH)3(胶体)+3HCl 逐渐变深 Fe(OH)3胶粒吸附阳离子带电荷 电泳 生成红褐色沉淀 先沉淀后溶解 因为硫酸是电解质,向胶体中加入电解质,首先发生聚沉,得到沉淀,随着加入过量的硫酸,H+与Fe(OH)3发生反应Fe(OH)3+3H+=Fe3++3H2O,使沉淀溶解
【解析】
实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,反应的化学方程式为FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl,得到的是Fe(OH)3胶体;
Fe(OH)3(胶体)+3HCl,得到的是Fe(OH)3胶体;
(1)由于Fe(OH)3胶体粒子带有电荷,在电场的作用下,胶体粒子在分散剂里向阴极移动,阴极附近的颜色逐渐变深,表明Fe(OH)3胶粒吸附阳离子带电荷,这种现象叫电泳;
(2)向胶体中加入少量电解质溶液时,电解质电离生成的离子中和了Fe(OH)3胶粒所带的正电荷,使胶粒聚集成较大的颗粒而形成红褐色沉淀;
(3) 因为硫酸是电解质,向胶体中加入电解质,首先发生聚沉,得到沉淀,随着加入过量的硫酸,H+与Fe(OH)3发生反应Fe(OH)3+3H+=Fe3++3H2O,使沉淀溶解,故现象为先沉淀后溶解。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】(1)在标准状况时,8.96L的容器里所含CO的质量为11.2g,则一氧化碳的摩尔质量为____________ g/mol ;
(2)3.01×1023个OH-的物质的量是 __________ mol,质量为_____g,其质子数为________(用NA表示),电子数为 ___________(用NA表示);
(3)同温同压下同体积的H2和A气体的质量分别是0.2 g和1.6 g,则气体A的相对分子质量为________,含有A的分子个数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,氧杂螺戊烷的结构简式为![]() ,则下列说法正确的是
,则下列说法正确的是
A. lmol该有机物完全燃烧需要消耗5.5molO2
B. 二氯代物超过3种
C. 该有机物与环氧乙烷互为同系物
D. 该有机物所有碳、氧原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据反应回答下列问题:K2Cr2O7+14HCl=2KCl+2CrCl3+7H2O+3Cl2↑
①用双线桥法分析该氧化还原反应(标明得失电子及数目):__
K2Cr2O7+14HCl=2KCl+2CrCl3+7H2O+3Cl2↑
②以上反应中还原产物是__,氧化剂与还原剂的物质的量之比为___。
(2)写出下列化学反应的离子方程式:
①过氧化钠与水反应___。
②钠单质与水反应___。
③醋酸与氢氧化钾溶液反应___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。

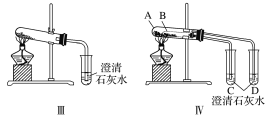
(1)图Ⅰ、Ⅱ所示实验中,__(填序号)能够较好达到实验目的。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,两个实验的发生装置中反应的化学方程式为:__;与实验Ⅲ相比,实验Ⅳ的优点是___(填字母)。
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ比Ⅲ操作简便
D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是__(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香化合物A是一种基本化工原料,可以从煤和石油中得到。A、B、C、D、E的转化关系如图所示:回答下列问题:
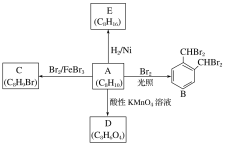
⑴A的化学名称是______;与A互为同分异构体的芳香化合物还有 _____种,其中核磁共振氢谱图上显示有5个峰,且峰面积之比为1:2:2:2:3的物质的结构简式为:________________。
⑵A→B的反应类型是_______。
⑶A→E的化学方程式为____________________。
⑷A与酸性KMnO4溶液反应可得到D,写出D的结构简式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安全气囊逐渐成为汽车的标配,因为汽车发生剧烈碰撞时,安全气囊中迅速发生反应:10NaN3+2KNO3![]() K2O+5Na2O+16N2↑,产生大量的气体使气囊迅速弹出,保障驾乘车人员安全。下列关于该反应的说法不正确的是
K2O+5Na2O+16N2↑,产生大量的气体使气囊迅速弹出,保障驾乘车人员安全。下列关于该反应的说法不正确的是
A. 该反应中NaN3是还原剂,KNO3是氧化剂
B. 氧化产物与还原产物的物质的量之比为15∶1
C. 若有50.5 g KNO3参加反应,则有1 mol N原子被还原
D. 每转移1 mol e,可生成标准状况下N2的体积为35.84 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________________(填序号),配制上述溶液还需用到的玻璃仪器是_____________(填仪器名称)。

(2)配制0.1mol/L NaOH 溶液操作步骤如下:正确顺序是___________________
①把称量好的NaOH固体放入小烧杯中,加适量的蒸馏水溶解;
②把①所得溶液冷却至室温,再小心转入一定容积的容量瓶中;
③继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶瓶塞塞紧,充分摇匀.
(3)根据计算用托盘天平称取NaOH的质量为______g.在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度_________0.10mol/L(填“大于”“小于”或“等于”,下同).若还未等溶液冷却就定容了,则所得溶液浓度___________0.10mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 钠和冷水反应:Na+2H2O=Na++2OH+H2↑
B. 澄清石灰水与少量NaHCO3溶液混合:Ca2+ + OH-+ HCO3-![]() CaCO3↓+ H2O
CaCO3↓+ H2O
C. 向沸水中滴入适量的饱和氯化铁溶液;Fe 3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
D. 碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3-+ OH-=CO32-+ H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com