
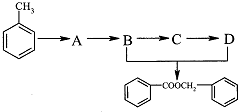

 的化学方程式为
的化学方程式为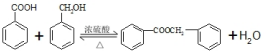
分析 (1)乙烯与溴水加成生成1,2-二溴乙烷,1,2-二溴乙烷难溶于水,密度大于水,据此答题;
(2)根据各物质的转化关系,由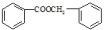 的结构及B生成C,C生成D可知,B为
的结构及B生成C,C生成D可知,B为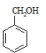 ,D为
,D为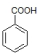 ,所以C为
,所以C为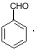 ,A的化学式为C7H7Cl,所以A为
,A的化学式为C7H7Cl,所以A为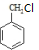 ,甲苯在光照条件与氯气发生取代生成氯甲苯,据此答题.
,甲苯在光照条件与氯气发生取代生成氯甲苯,据此答题.
解答 解:(1)乙烯与溴水加成生成1,2-二溴乙烷,1,2-二溴乙烷难溶于水,密度大于水,乙烯通入到Br2水中,现象是溴水褪色,溶液分为两层且上层、下层均无色,反应的方程式为CH2=CH2+Br2→CH2BrCH2Br,
故答案为:溴水褪色,溶液分为两层且上层、下层均无色;CH2=CH2+Br2→CH2BrCH2Br;
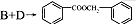
(2)根据各物质的转化关系,由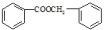 的结构及B生成C,C生成D可知,B为
的结构及B生成C,C生成D可知,B为 ,D为
,D为 ,所以C为
,所以C为 ,A的化学式为C7H7Cl,所以A为
,A的化学式为C7H7Cl,所以A为 ,甲苯在光照条件与氯气发生取代生成氯甲苯,
,甲苯在光照条件与氯气发生取代生成氯甲苯,
①B-C的化学方程式为 ,
,
故答案为: ;
;
② 的化学方程式为
的化学方程式为  ,
,
故答案为: ;
;
③A为 ,则含有苯环的A的同分异构体还有苯环上连有-CH3和-Cl,有邻间对三种,
,则含有苯环的A的同分异构体还有苯环上连有-CH3和-Cl,有邻间对三种,
故答案为:3.
点评 本题考查有机物的合成,明确合成中物质的结构、官能团及反应条件来推断各物质是解答本题的关键,注意体会正逆合成法的综合应用来分析,题目难度中等.


科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
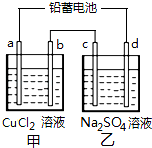 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )| A. | d极为阴极 | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2+4H++SO42-+4e-═PbSO4+2H2O | |
| C. | 若利用甲池精炼铜,b极应为粗铜 | |
| D. | 若电极材料均为石墨,当析出6.4g Cu时,两池共产生气体3.36L(标准状况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 陈述Ⅰ | 陈述Ⅱ | |
| A | BaSO4难溶于水 | SO2气体通入Ba(NO3)2溶液中沉淀 |
| B | 非金属性:Cl>S | 酸性:HClO3>H2SO4 |
| C | 常温下,NaHCO3的溶解度比Na2CO3小 | 向饱和Na2CO3溶液中通入CO2产生沉淀 |
| D | 常温下,SO2与氢硫酸和NaOH溶液均可反应 | SO2是两性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
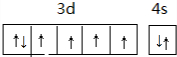 .
. 的沸点高.(填高或低)
的沸点高.(填高或低)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠盐 | B. | 钾盐 | C. | 铁盐 | D. | 钙盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.0176 | B. | 0.1600 | C. | 0.1200 | D. | 0.2400 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
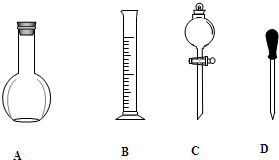 实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
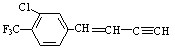 分子的下列叙述中,错误的是( )
分子的下列叙述中,错误的是( )| A. | 该物质使酸性高锰酸钾溶液褪色 | |
| B. | 一分子该物质能与6分子H2加成 | |
| C. | 最多有18个原子可能处在同一平面上 | |
| D. | 分子式为C11H6ClF3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com