
| A. | 2n+3m-a | B. | m+2-a | C. | n+m+a | D. | m+2n+2-a |
分析 有机物主要靠C原子连接,每个碳原子都必须形成4个共价键,以1条碳链分析考虑,先分析若只连接甲基,计算连接的甲基数目,再根据分子中含有的甲基数目计算Cl原子数.1个-CH-可连接1个甲基,-CH2-不管多少个只能连接两个-CH3.以此解答该题.
解答 解:若只连接甲基,-CH2-不管多少个只能连接两个-CH3,m个-CH-,能连接m个-CH3,所以n个-CH2-,m个-CH-,连接-CH3共计m+2个.由于分子中含有a个-CH3,所以连接Cl的个数为m+2-a.
故选B.
点评 本题考查有机化合物中成键特征,为高频考点,侧重考查学生的分析能力,难度中等,关键清楚有机物主要靠C原子连接,每个碳原子都必须形成4个共价键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,反应 C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| B. | 合成氨反应 N2(g)+3H2(g)?2NH3(g)△H<0,加入催化剂能加快化学反应速率并提高转化率 | |
| C. | 甲烷和乙醇的燃烧热分别是 891.0 kJ/mol、1366.8 kJ/mol,利用甲烷更“低碳” | |
| D. | 氢氧燃料电池发电,比氢气直接在空气中燃烧发电能量转化率高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 300 | 230 | 169 | 58 |
| 30 | 158 | 108 | 50 | 15 |
| 50 | 31 | 26 | 15 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NH3所含有的电子数为 17NA | |
| B. | 常温常压下,22.4 L 氧气所含的原子数为 2NA | |
| C. | 常温常压下,48g O3 所含的氧原子数为 3NA | |
| D. | 1 mol/L NaCl 溶液中所含的 Na+数为 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 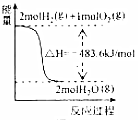 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ•mol-1 | |
| B. | 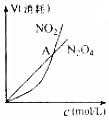 表示恒温恒容条件下发生的可逆反应2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 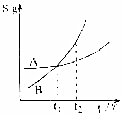 表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数A=B | |
| D. | 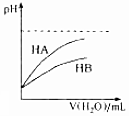 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| B. | 正四面体分子晶体内的键角一定是109°28′ | |
| C. | CuSO4溶液能使蛋白质溶液产生沉淀,该过程可用于提纯蛋白质 | |
| D. | NH3•H2O溶液加水稀释后,溶液中$\frac{c(N{H}_{3}{H}_{2}O)}{c(N{H}_{{4}^{+}})}$的值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
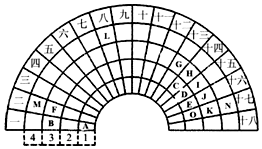 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题:
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题: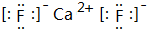 ,用电子式表示CJ2的形成过程:
,用电子式表示CJ2的形成过程: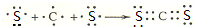 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2在反应中作氧化剂,又作还原剂 | |
| B. | 高铁酸钾在该温度下的溶解度比高铁酸钠的溶解度小 | |
| C. | K2FeO4能消毒杀菌,其还原产物水解生成的Fe(OH)3胶体能吸附水中的悬浮物 | |
| D. | 制取高铁酸钠时,每生成1mol Na2FeO4反应中共有4mol电子转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com