
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主要成分为MnO2,另含有少量头铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已略去)。
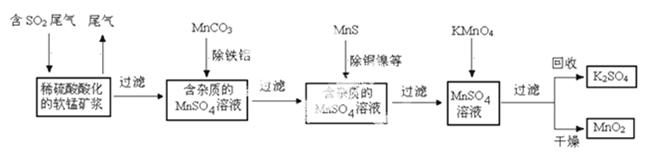
请回答下列 问题:
问题:
(1)上述流程脱硫实现了____(选填下列字母编号)。
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)用MnCO3能除去溶液中Al3+和Fe3+,其原因是_____。
(3)已知:25℃、101kpa时,Mn(s)+O2(g)=MnO2(s) △H=-520kJ/mol
S(s)+O2(g)=SO2(g) △H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ/mol
SO2与MnO2反应生 成无水MnSO4的热化学方程式是________________。
成无水MnSO4的热化学方程式是________________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是
_ _。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是______。
(6)假设脱除的 SO2只与软锰矿浆中的
SO2只与软锰矿浆中的 MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、
MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
现有乙酸和两种链状单烯烃(分子中含一个碳碳双键)的混合物,若其中氧的质量分数为a,则碳的质量分数是( )
A.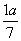 B.
B.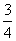 a
a
C.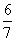 (1-a) D.
(1-a) D.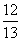 (1-a)
(1-a)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除杂方法正确的是 ( )
A.除去乙烷中少量的乙烯:通入H2,加催化剂反应
B.除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液
C.除去NaBr溶液中的NaI:用氯水氧化NaI,再用CCl4萃取分液
D.除去乙醇中少量的乙酸:加足量生石灰,蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
下图为苯和溴的取代反应的改进实验装置图。其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入铁屑粉少量。
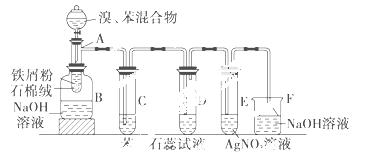
填写下列空白:(注:溴苯与NaOH溶液不可以发生水解反应)
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):(2分)
______________________________________________________ __________________
_________________________________________ _______________________________。
(2)试管C中苯的作用是__ _______;反应开始后,观察D和E试管,看到的现象为:D中:__ ________ _________ ;E中:________ ______。(各2分)
_______;反应开始后,观察D和E试管,看到的现象为:D中:__ ________ _________ ;E中:________ ______。(各2分)
(3)反应2 min至3 min后,在B中的NaOH溶液可观察到的现象是(2分)
________________________________________________________________________。
(4)在上述整套装置中,具有防倒吸的仪器有________(填字母)。(2分,错选无分)
(5)改进后的实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这3个优点外,还有一个优点是:(2分 )
)
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质为原料冶炼铝的工艺流程如下:
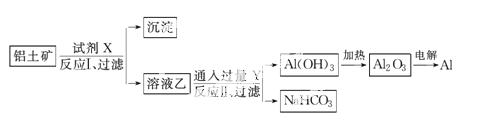
对上述流程中的判断正确的是( )
A.试剂X为稀硫酸,沉淀中含有硅的化合物
B.反应Ⅱ中生成Al(OH)3的反应为CO2+AlO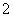 +H2O===Al(OH)3↓+HCO
+H2O===Al(OH)3↓+HCO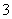
C.结合质子(H+)的能力由强到弱的顺序是OH->AlO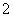 >CO
>CO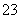
D.Al2O3的熔点很高,工业上还可采用电解熔融AlCl3冶炼Al
查看答案和解析>>
科目:高中化学 来源: 题型:
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应 TiO2(s)+CCl4(g)
TiO2(s)+CCl4(g) TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
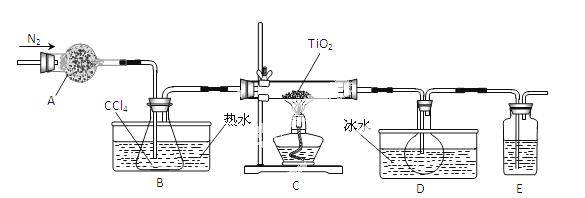
有关物质性质如下表
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
仪器A的名称是 ,装置E中的试剂是 。反应开始前依次进行如下操作:组装仪器、 、加装药品、通N2一段时间后点燃酒精灯。反应结束后的操作包括:①停止通N2 ②熄灭酒精灯 ③冷却至室温。正确的顺序为 (填序号)。欲分离D中的液态混合物,所采用操作的名称是 。
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
|
水解 TiOSO4(aq)+ 2H2O(l)== H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:
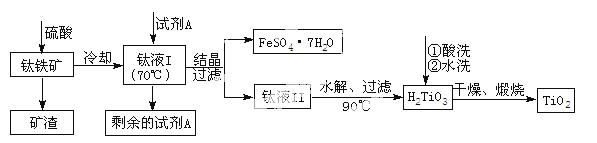
①试剂 A为 。钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品TiO2收率降低,原因是 。
A为 。钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品TiO2收率降低,原因是 。
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是 。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是 (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

查询资料,得有关物质的数据如下表:
| 25 ℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
(1)检验制得的绿矾晶体中是否含有Fe3+,可选用的试剂为________。
A.KSCN溶液 B.NaOH溶液
C.KMnO4溶液 D.苯酚溶液
(2)操作Ⅱ中,通入硫化氢至饱和的目的是____________;在溶液中用硫酸酸化至pH=2的目的是_______________________________________________________。
(3)操作Ⅳ的顺序依次为____________、冷却结晶、_________________________。
(4)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
2009“中国水周”的主题是:“落实科学发展观,节约保护水资源”。下列认识和做法不符合这一主题的是 ( )
A.洗菜、洗衣、 淘米的水用来浇花、拖地、冲厕所
淘米的水用来浇花、拖地、冲厕所
B.加强工业废水的排放监控,坚持达标排放
C.合理施用农药、化肥,以减少水体污染
D.淡水资源丰富,所以淡水可以取之不尽、用之不竭
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com