
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)相同质量的CO和CO2,它们所含的原子数之比为___________,标准状况下,含有相同氧原子数的CO和CO2的体积之比为_____________。
(2)若a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是___________(设NA为阿伏加德罗常数的值)。
(3)标准状况下有①0.112 L水 ②0.5NA个HCl分子 ③25.6 g SO2气体 ④0.2 mol氨气(NH3) ⑤2 mol Ne 所含原子个数从大到小的顺序为___________。
(4)V mL Fe2(SO4)3溶液中,含有Fe 3+ m g,取出![]() mL该溶液稀释至4V mL,则溶液中SO42-的物质的量浓度为___________________。(用含有m、V的式子表示)
mL该溶液稀释至4V mL,则溶液中SO42-的物质的量浓度为___________________。(用含有m、V的式子表示)
【答案】22:21 2:1 ![]() ①⑤③②④
①⑤③②④ ![]() mol/L
mol/L
【解析】
(1)设CO和CO2的质量相同,根据m=nM,物质的量和摩尔质量成反比,所以它们的物质的量之比为44:28=11:7,所含的原子数之比为11×2:7×3=22:21。CO和CO2所含的氧原子数相同,则它们的分子数之比即物质的量之比为2:1,标准状况下,物质的量和体积成正比,故CO和CO2的体积比为2:1。
(2)若a g某气体中含有的分子数为b,则c g该气体含有的分子数为![]() ,物质的量为
,物质的量为![]() =
=![]() mol,在标准状况下的体积是
mol,在标准状况下的体积是![]() mol×22.4L/mol=
mol×22.4L/mol=![]() L。
L。
(3)①0.112 L水的质量为112g,物质的量为6.2mol,原子的物质的量为6.2×3=18.6mol;
②0.5NA个HCl分子的物质的量为0.5mol,原子的物质的量为1mol;
③25.6 g SO2气体的物质的量为![]() =0.4mol,原子的物质的量为1.2mol;
=0.4mol,原子的物质的量为1.2mol;
④0.2 mol氨气(NH3)中所含原子的物质的量为0.8mol;
⑤2 mol Ne 所含原子的物质的量为2mol;
所以所含原子个数从大到小的顺序为①⑤③②④。
(4)n(Fe3+)=![]() mol,在Fe2(SO4)3中n(SO42-)=1.5n(Fe3+)=
mol,在Fe2(SO4)3中n(SO42-)=1.5n(Fe3+)=![]() mol,从V mL Fe2(SO4)3溶液中取出的
mol,从V mL Fe2(SO4)3溶液中取出的![]() mL溶液中n(SO42-)=
mL溶液中n(SO42-)=![]() mol,稀释至4V mL,溶液中SO42-的物质的量浓度为
mol,稀释至4V mL,溶液中SO42-的物质的量浓度为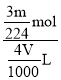 =
=![]() mol/L。
mol/L。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】标准状况下有①6.72LCH4;②3.01x1023个HCl;③13.6gH2S;④0.2molNH3。下列对四种气体的关系从小到大表示不正确的是( )
A.体积:④<①<②<③
B.密度:①<④<③<②
C.质量:④<①<③<②
D.氢原子数:②<④<③<①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用下列装置测定SO2催化氧化为SO3的转化率(部分夹持装置已省略,已知SO3的熔点为16.8℃,假设气体进入装置时均被完全吸收,且忽略空气中CO2的影响),下列说法不正确的是( )
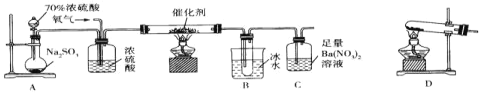
A.A装置烧瓶中发生的反应可以表示为SO32-+2H+=SO2↑+H2O
B.用D装置制备氧气,试管中的药品可以是KClO3
C.当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气
D.C中产生的白色沉淀是BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbCO3可用于油漆、陶瓷和玻璃等工业。由方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2)制备PbCO3的流程如下:
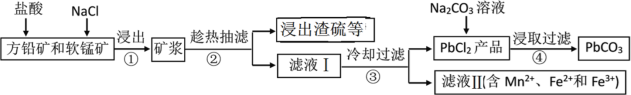
已知:PbCl2难溶于冷水和乙醇,易溶于热水;各物质的溶度积见表。试回答下列问题:
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | PbCl2 | PbS | PbCO3 |
Ksp | 2×10-13 | 8.0×10-16 | 1×10-38 | 1.6×10-5 | 8.0×10-28 | 7.4×10-14 |
(1)PbCO3的名称是________。
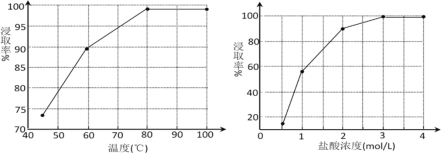
(2)步骤①中MnO2的作用是________,根据下图分析过程①的最佳反应条件是_________。
(3)步骤②趁热抽滤的原因是___________________。
(4)步骤③洗涤用的试剂是____________。
(5)将滤液Ⅱ先酸化,然后加入MnO2,反应的离子方程式为________;若反应后![]() ,进一步调节溶液的pH可分离出Fe3+和Mn2+,则调节溶液pH的范围为_________
,进一步调节溶液的pH可分离出Fe3+和Mn2+,则调节溶液pH的范围为_________![]() 时表示Fe3+已沉淀完全]。
时表示Fe3+已沉淀完全]。
(6)步骤④反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B、C均为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去)。
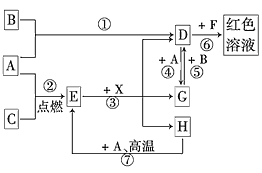
(1)在反应①~⑦中,不属于氧化还原反应的是________(填编号)。
(2)写出③的离子方程式:________________
(3)反应⑦的化学方程式为____;该反应中每消耗0.3 mol的A,可转移电子_________mol。在解决此题时的关键一步是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国海军航母建设正在有计划、有步骤向前推进,第一艘国产航母目前正在进行海试。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+基态原子的核外电子排布为_______,铬元素在周期表中______区。
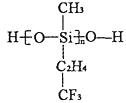
(2)航母甲板涂有一层耐高温的材料聚硅氧烷结构如图所示,其中C原子杂化方式为_______杂化。
(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是______填元素符号
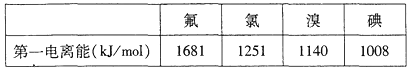
②根据价层电子对互斥理论,预测ClO3-的空间构型为______形,写出一个ClO3-的等电子体的化学符号______。
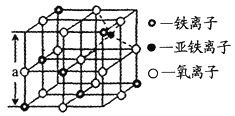
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、铁、锰、锌等。如右图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,则晶体中的离子是否构成了面心立方最密堆积?_____(填“是”或“否”);该立方体是不是Fe3O4的晶胞?______(填“是”或“否”);立方体中铁离子处于氧离子围成的_______(填空间结构)空隙;根据下图计算Fe3O4晶体的密度为________g/cm3。(图中a=0.42nm,计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年研究表明离子液体型催化剂GIL可对某些特定加成反应有很好的催化作用,有机化合物H的合成路线如下: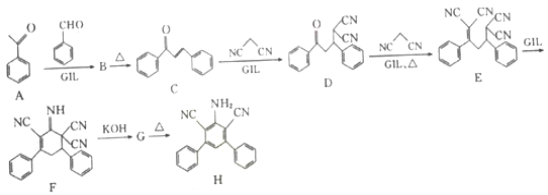
(1) C中含有的官能团名称为______________。
(2) C—D的反应类型为______________。
(3)已知:G和H的分子式相同,F→G和B→C反应类型均为消去反应,那么G的结构简式为______________。
(4)写出满足下列条件的B的一种同分异构体X的结构简式: ______________。
①1 mol X完全水解消耗2 mol NaOH;
②水解酸化后两种产物核磁共振氢谱均有4个峰,峰高比为3:2:2:1。
X在酸性条件下发生水解反应的产物名称为_________。
(5)以乙醇为原料利用GIL合成聚酯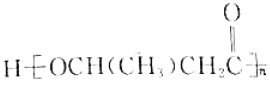 写出合成路线流程图(无机试剂可任选,合成路线流程图示例见本题题干)______________。
写出合成路线流程图(无机试剂可任选,合成路线流程图示例见本题题干)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是( )
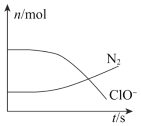
A.该反应中Cl-为氧化产物
B.NH4+是还原剂,ClO-是氧化剂
C.消耗1mol还原剂,转移6mol电子
D.反应后溶液的酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】DCCNa (二氯异氰尿酸钠)固体是一种高效、安全的消毒剂。20℃以上易溶于水。(CNO)3H3 (氰尿酸)为三元弱酸。
I.制备DCCA (二氯异氰尿酸)装置如图。主要反应有:
碱溶 (CNO)3H3+ 2NaOH=(CNO)3Na2H + 2H2O △H<0
氯化 (CNO)3Na2H +2Cl2=(CNO)3Cl2H + 2NaCl H<0
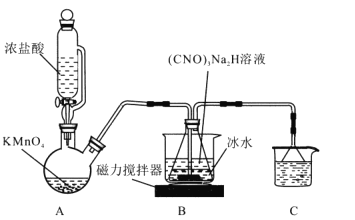
回答下列问题:
(1)装置C中的溶液是______________,作用为______________。
(2)装置A中反应的离子方程式为_______________。
(3)装置B用冰水浴的原因是__________, 碱溶时若氢氧化钠过量,(CNO)3Na2H中可能混有的杂质是__________。
Ⅱ.制备DCCNa
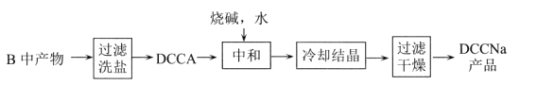
(4)步骤II中过滤洗盐”洗去的盐是__________________。
(5)“中和”反应的化学方程式为_________________。
(6)氧元素含量的测定:称取0. 1000 g DCNa样品,加入一定量醋酸溶液溶解,样品中的氯元素全邵转化成HClO,再加入足量的KI溶液,用淀粉作指示剂, 用01000 mol·L-1Na2S2O3标准溶液滴定生成的碘,消耗VmL.已知: I2+2S2O32-=2I-+S4O62-,样品中氯元素的质量分数=__________%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com