
| A. | 反应是放热反应还是吸热反应,由生成物与反应物的焓值差决定 | |
| B. | 升高温度,可以改变化学反应的反应热 | |
| C. | △H的大小与热化学方程式中的化学计量数无关 | |
| D. | 1 mol H2在足量Cl2中完全燃烧所放出的热量,是H2的燃烧热 |
分析 A.反应放热或吸热是由反应物和生成物的焓值差决定;
B.反应热通常是指:体系在等温、等压过程中发生物理或化学的变化时所放出或吸收的热量;恒压时反应热为反应的焓变;
C.△H的大小与热化学方程式中的化学计量数成正比;
D.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量.
解答 解:A.反应放热或吸热是由反应物和生成物的焓值差决定,反应物的总焓值大于生成物的总焓值,则为放热反应,反之为吸热反应,故A正确;
B.升高温度改变化学平衡,改变反应吸收或放出的热量,但不改变恒压反应热即焓变,故B错误;
C.△H的大小与热化学方程式中的化学计量数成正比,所以热化学方程式中计量数越大,则△H的数值越大,故C错误;
D.燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,1mol H2在足量Cl2中完全燃烧所放出的热量不符合燃烧热概念,故D错误.
故选A.
点评 本题考查了化学反应能量变化的分析判断,注意恒压反应热的理解、燃烧热、中和热概念的分析判断,题目难度不大,侧重于考查学生对基础知识的应用能力.


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:多选题
| A. | 用1g 98%的浓硫酸加入4g水配制1:4硫酸溶液 | |
| B. | 配制2.0mo1•L-1硫酸溶液时,最后在容量瓶中加水稀释到标线,塞好盖子倒转摇匀后,发现液面低于标线 | |
| C. | 在100mL无水乙醇中,加人2g甲醛配制2%的甲醛洒精溶液 | |
| D. | 在80mL水中,加入18.4mol•L-1浓硫酸20mL,配制3.68mol•L-1稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
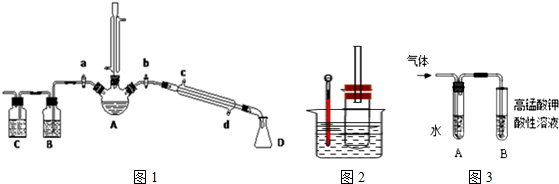
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D四种短周期元素,且A、B、D为相邻的同周期元素,C、B同主族,B、C可形成共价化合物BC3和BC2,A的原子结构示意图图,据此填空:
A、B、C、D四种短周期元素,且A、B、D为相邻的同周期元素,C、B同主族,B、C可形成共价化合物BC3和BC2,A的原子结构示意图图,据此填空:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有较强酸性和还原性 | 易溶于水,难溶于乙醇 |
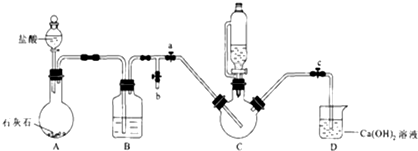
| 实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
| 产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.86 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
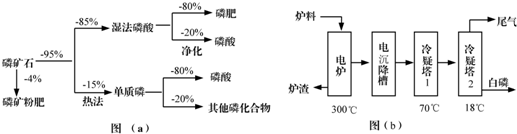
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸与0.1 mol•L-1 NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1 | |
| B. | 氢气的标准燃烧热为285.5 kJ•mol-1,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=285.5 kJ•mol-1 | |
| C. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量. 则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的标准燃烧热为110.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A原子最外电子层上的电子数比B少 | |
| B. | B单质的氧化性大于A单质 | |
| C. | A的非金属性比B强 | |
| D. | B的气态氢化物稳定性大于A的气态氢化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com