
�ҹ�����ר�Һ�°�ġ������Ƽ����Ϊ�����Ƽҵ������ͻ�����ס�����NaCl��NH3 ��CO2��Ϊԭ�����Ƶ�NaHCO3����������������йط�Ӧ�Ļ�ѧ����ʽΪ��NH3 + CO2 + H2O = NH4HCO3 �� NH4HCO3 + NaCl = NaHCO3��+ NH4Cl �� 2NaHCO3 = Na2CO3 + CO2��+ H2O
��1��̼������뱥��ʳ��ˮ��Ӧ��������̼�����ƾ����ԭ���� �����ţ���
A��̼������������ˮ B��̼�����������ֽ�
C��̼�����Ƶ��ܽ����Խ�С����������Һ�����Ƚᾧ����
��2��ij̽���С����������Ƽ�ԭ��������̼�����Ƶ��Ʊ�ʵ�飬ͬѧ�ǰ�������Ƶķ���ʵ�顣
�� һλͬѧ��������̼����ͨ�뺬���ı���ʳ��ˮ���Ʊ�̼�����ƣ�ʵ��װ������ͼ��ʾ��ͼ�мг֡��̶��õ�����δ��������

�Իش������й����⣺
 ������װ���е��Լ��� ��
������װ���е��Լ��� ��
����װ����ϡ����������� ��
����ʵ����������NaHCO3 ����IJ����� ���������������ƣ���
�� ��һλͬѧ��ͼ����װ�ã�����װ��δ����������ʵ�顣
����ʵ��ʱ�����ȴ� ��ͨ�� ���壬�ٴ� ����ͨ�� ���塣
������ͬѧ��������װ�õ�b���¶����Ӽ�װ�ã������� .
��3��������д��һ��ʵ������ȡ����̼�����Ƶķ����� .

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��������������һ�и߶��µڶ����¿���ѧ���������棩 ���ͣ�ʵ����
ʵ����������������������Ҵ��Ʊ�1,2�����������װ������ͼ��ʾ��
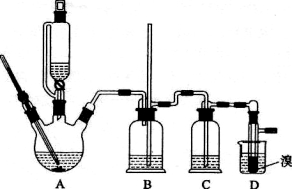
�й������б����£�
�ش��������⣺
��1��д����ʵ������� ������������Ҫ��Ӧ�Ļ�ѧ����ʽ__________________________��
������������Ҫ��Ӧ�Ļ�ѧ����ʽ__________________________��
��2���ڴ��Ƹ�ʵ���У�Ҫ������Ѹ�ٵذѷ�Ӧ�¶�170�����ң�������ҪĿ���� ____.
(����ȷѡ��ǰ����ĸ,��ͬ)
a.������Ӧ b.�ӿ췴Ӧ�ٶ� c����ֹ�Ҵ��ӷ� d�����ٸ�������������
��3����װ��C��Ӧ���� ����Ŀ�������շ�Ӧ�п������ɵ��������壮
a��ˮ b��Ũ���� c������������Һ d������̼��������Һ
��4���жϸ��Ʊ���Ӧ�Ѿ�������������� ����ʵ������
��5����1��2-��������ֲ�Ʒ���ڷ�Һ©���м�ˮ�����ã�����Ӧ��_______��
��6����������������δ��Ӧ��Br2������� ϴ�ӳ�ȥ��
a��ˮ b������������Һ c���⻯����Һ d���Ҵ�
��7�������������������������ѣ����� �ķ�����ȥ��
��8����Ӧ������Ӧ����ˮ��ȴװ��D������ҪĿ���� �����ֲ��ܹ�����ȴ(���ñ�ˮ)����ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ��һ�µ����ο��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���з�Ӧ��������Ϊԭ��ع���ʱ�����ķ�Ӧ����
A��Cu+2AgNO3��Cu(NO3)2+2Ag B��2Fe+O2+2H2O��2Fe(OH)2
C��NaOH+HCl��NaCl+H2O D��2H2+O2��2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�캣��ʡ����ȫ��ģ�����ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£�0.1 mol/L���Ȼ��ˮ��Һ�У�������������ϵ��ȷ����
A����Һ�ʼ���
B��c(NH3��H2O)+c(NH4+)��0.1 mol/L
C��c(NH4+)+c(H+)��c(OH��)+c(Cl��)
D���Ȼ�淋ļ���ɴٽ�ˮ�ĵ��룬ʹKw > 1.0��10��14
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ����ʮ��ģ���ƻ�ѧ�Ծ��������棩 ���ͣ��ƶ���
���л���ѧ�����������ᱽ���� ��һ����Ȼ����ҩ���һ���������ܷ�������ת����
��һ����Ȼ����ҩ���һ���������ܷ�������ת����
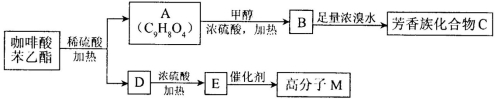
����д���пհס�
��1�������ᱽ�����еĺ����������� ��
��2��B��C�����ķ�Ӧ������ ��
��3��M�Ľṹ��ʽ�� ��
��4��д��A��B��Ӧ�Ļ�ѧ����ʽ�� ��
��5��д���л���Aͨ���Ӿ۷�Ӧ�γɸ߷��ӻ�����Ļ�ѧ����ʽ ��
��6��A��ͬ���칹��ܶ��֣����У�ͬʱ��������������ͬ���칹���� �֡�
�ٱ�����ֻ������ȡ������
���ܷ���������Ӧ��
������̼��������Һ��Ӧ��
�������Ȼ�����Һ������ɫ��Ӧ��
��7���л���H��A��һ��ͬ���칹�壬����A������ͬ�������Ŀ�Ĺ����ţ�H�����й���6�ֲ�ͬ��ѧ��������ԭ�ӣ��Һ˴Ź������ķ������Ϊ1:1:1:1:2:2,д����������������H�Ľṹ��ʽ (д��һ�ּ��ɣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ����ʮ��ģ���ƻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ���ǣ� ��
A�����顢�촼����ϩ������������ͬ���칹����Ŀ���ٵ�����ϩ
B������ʽΪC4H9Cl���л���������4��
C����ϩ��HCl��һ�������µIJ���ֻ��һ��
D����CH2(NH2)-COOH��CH3-CH(NH2)-COOH���ְ�������ˮ������������3��2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����������·һ�и���5���¿����ƻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
�������ƣ�NaNO2����һ�ֳ�����ʳƷ���Ӽ���ʹ��ʱ�����ϸ������������ij��ȤС���������ʵ��̽������������֪������2NO+Na2O2=2NaNO2 ��2NO2+Na2O2=2NaNO3������KMnO4��Һ�ɽ�NO2������ΪNO3����MnO4����ԭ��Mn2+��
��Ʒ�Ʊ�����飺����ͼ1װ���Ʊ�NaNO2��
��1��д��װ��A��ƿ�з�����Ӧ�Ļ�ѧ����ʽ���������ת�Ƶķ������Ŀ__________
��2��Bװ�õ�������_______
��3����ͬѧ��Ϊװ��C�в��ﲻ�����������ƣ����������ơ�̼���ơ��������ƣ�Ϊ�Ʊ�����NaNO2Ӧ��B��Cװ�ü�����һ��װ�ã������ҿ��ڻ������ӵ�װ��ͼ2��������ʢ�ŵ��Լ���
��4�������ʵ�����װ��C��NaNO2�Ĵ��ڣ�д������������ͽ��ۣ�_____________________
�����IJⶨ
��ȡװ��C�з�Ӧ��Ĺ���4.00g����ˮ���250mL��Һ��ȡ25.00mL��Һ����ƿ�У���0.1000mol/L����KMnO4��Һ���еζ���ʵ�������������±���ʾ��

��5����һ��ʵ�����ݳ� ���쳣����������쳣��ԭ�������________��˫��ѡ��
���쳣����������쳣��ԭ�������________��˫��ѡ��
A����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ
B����ƿϴ����δ����
C���ζ��������Ӷ���
D���ζ��������Ӷ���
��6�����ݱ������ݣ��������ù������������Ƶ���������________���������4λ��Ч���֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���������ʦ���и����µ����������ƻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
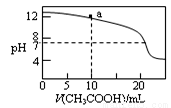
�����й���Һ������Ũ�ȵĹ�ϵʽ�У���ȷ���ǣ� ��
A��pH��ͬ�Ģ�CH3COONa����NaHCO3������Һ�е�c(Na��)���ڣ���
B��0.1mol��L��1ij��Ԫ����ǿ����NaHA��Һ�У�c(Na+)=2c(A2-)��c(HA-)��c(H2A)
C����ͼ��ʾ��0.1 mol/L CH3COOH��Һ�ζ�20 mL 0.1mol/L NaOH��Һ�ĵζ����ߣ���pH��7ʱ��c(Na��)��c(CH3COO��) ��c(OH��)��c(H��)
D����ͼa����Һ�и�����Ũ�ȵĹ�ϵ�ǣ�c(OH��)��c(H��)��c(CH3COO��)��2c(CH3COOH)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�걱���к��Ϸ�У��һ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
���Ѵﵽƽ��Ŀ��淴Ӧ2SO2+O2 2SO3�У�������
2SO3�У�������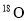 ��ɵ�����һ��ʱ���
��ɵ�����һ��ʱ��� ���������������е�( )
���������������е�( )
A�������������
B�����ɵ�����������
C�������Ͷ���������
D��������������������������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com