
| A. | 烧碱、冰醋酸、四氯化碳均为电解质 | |
| B. | 不同元素的原子构成的分子中只含极性共价键 | |
| C. | IA族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| D. | 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下可自发进行,则该反应的△H>0 |
分析 A.电解质是水溶液中或熔融状态能导电的化合物,四氯化碳是非电解质;
B.H、O形成的化合物中能存在非极性共价键;
C.IA族含H及碱金属元素,ⅦA族均为非金属元素;
D.根据△H-T△S<0时反应能自发进行分析;
解答 解:A.烧碱是氢氧化钠,水溶液中或熔融状态完全电离是强电解质、冰醋酸水溶液中部分电离是弱电解质、四氯化碳水溶液中或熔融状态都不导电,属于非电解质,故A错误;
B.H、O形成的化合物中能存在非极性共价键,如过氧化氢中H-O-O-H,存在极性键和非极性共价键,故B错误;
C.IA族含H及碱金属元素,ⅦA族均为非金属元素,则H与ⅦA族元素间可形成共价化合物,碱金属元素与ⅦA族元素间可形成离子化合物,故C正确;
D.该反应的△S<0,常温下能自发进行,△H-T△S<0,则△H<0,故D错误;
故选C.
点评 本题考查物质的分类、化学键的类型、元素周期表和元素周期律的综合应用、反应进行的方向等知识,为高频考点,CD两选项知识为解答的重点,注意B元素性质的特例,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | HClO的结构式:H-Cl-O | |
| B. | NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32- | |
| C. | 羟基的电子式: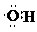 | |
| D. | 异丙醇的结构简式:CH3CH2CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解法精炼铜,当阴极质量增加32 g时,一定有6.02×1023个电子转移 | |
| B. | 含10.6 g Na2CO3的溶液中,所含阴离子总数等于6.02×1022 | |
| C. | 28 g由乙烯和氮气组成的混合气体中,含有6.02×1023个原子 | |
| D. | 含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为6.02×1022 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断开1molH-H键需要的能量小于断开1molCl-Cl键需要的能量 | |
| B. | 反应在光照和加热条件下的△H不同 | |
| C. | 反应①的活化能小于反应②的活化能 | |
| D. | 已知反应②的△H>0,则反应③的△H一定小于0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 海洋是巨大的资源宝库,具有美好的前景.
海洋是巨大的资源宝库,具有美好的前景. 所示.
所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 双氰胺结构简式如图.
双氰胺结构简式如图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C元素的单质在B元素的单质中燃烧,产物1mol与足量的水反应转移电子数为NA | |
| B. | 由上述元素形成的化合物只有一种具有漂白性 | |
| C. | B、C、D三种元素形成的化合物的水溶液用惰性电极电解时,溶液pH一定不变 | |
| D. | A、B形成化合物的沸点高于A、C形成化合物的沸点,因为前者分子间形成了氢键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com