
| A. | 1-丁烯和1,3-丁二烯 | B. | 己烷和环己烷 | ||
| C. | 尿素和氰酸铵(NH4CNO) | D. | 1,4-二甲苯和1,3,5-三甲苯 |
科目:高中化学 来源: 题型:选择题
| A. | <0.45mol | B. | 0.45mol | ||
| C. | 0.45-0.90mol之间 | D. | >0.90mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4△H1+0.05△H3 | B. | 0.4△H1+0.05△H2 | C. | 0.4△H1+0.1△H3 | D. | 0.4△H1+0.2△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为短周期元素,A的浓溶液与甲能发生如图所示的反应.甲是常见的黑色固体单质,乙是常见的气体单质,是空气的主要成分之一,B是无色气体,是主要的大气污染物之一,C常温下为无色液体,E是一种淡黄色的固体.请回答下列问题.
已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为短周期元素,A的浓溶液与甲能发生如图所示的反应.甲是常见的黑色固体单质,乙是常见的气体单质,是空气的主要成分之一,B是无色气体,是主要的大气污染物之一,C常温下为无色液体,E是一种淡黄色的固体.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.8 mol | B. | 0.6 mol | C. | 0.5 mol | D. | 0.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | a>b>c | B. | a>c>b | C. | a=b+m+n | D. | a=c+n+m |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
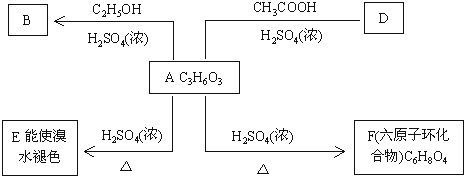

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式 | B. | Cl-的结构示意图: | ||
| C. | 乙烯的结构简式C2H4 | D. | Z质量数为37的氯原子${\;}_{37}^{17}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F 是前四周期原子电子轨道表示式中单电子数最多的元素 |
| G在周期表的第十一列 |
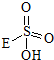 →
→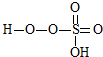 +HE,请写出横线上物质的结构式.
+HE,请写出横线上物质的结构式.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com