
分析 (1)若将4mol A和2mol B在2L的容器中混合,经2s后测得C的浓度为0.6mol/L,由方程式可知△c(A)=△c(C),△c(B)=$\frac{1}{2}$△c(C),根据v=$\frac{△c}{△t}$计算v(A),2s时物质B的浓度=B的起始浓度-△c(B);
(2)混合气体总物质的量减少6mol-4.2mol=1.8mol,利用差量法计算生成C的物质的量,进而计算C的体积分数;
若再通入少量B气体,平衡正向移动,体系中A的物质的量减小;若要使A的物质的量再达到与原平衡状态相同,可采取的措施使平衡逆向移动;
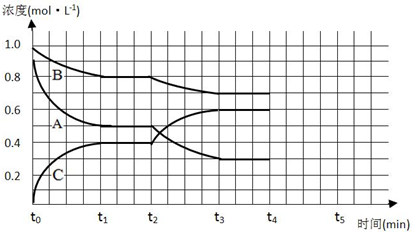
(3)t2时瞬间各物质的浓度未变,平衡正向移动,不可能是改变压强、改变某一物质的浓度,也不可能是使用催化剂,应是改变温度,正反应为放热反应,降低温度平衡正向移动.
解答 解:(1)若将4mol A和2mol B在2L的容器中混合,经2s后测得C的浓度为0.6mol/L,由方程式可知△c(A)=△c(C)=0.6mol/L,v(A)=$\frac{0.6mol/L}{2s}$=0.3mol/(L.s);
△c(B)=$\frac{1}{2}$△c(C)=0.3mol/L,2s时物质B的浓度=$\frac{2mol}{2L}$-0.3mol/L=0.7mol/L,
故答案为:0.3mol/(L.s);0.7mol/L;
(2)混合气体总物质的量减少6mol-4.2mol=1.8mol,则:
2A(g)+B(g)?2C(g) 物质的量减小
2 1
3.6mol 1.8mol
则平衡时C的体积分数为$\frac{3.6mol}{4.2mol}$×100%=85.7%;
若再通入少量B气体,平衡正向移动,体系中A的物质的量减小,若要使A的物质的量再达到与原平衡状态相同,可采取的措施使平衡逆向移动,正反应为气体物质的量减小的放热反应,可以升高温度或减小压强,也可以充入A气体,
故答案为:85.7%;减小;升高温度或减小压强或充入A气体;
(3)t2时瞬间各物质的浓度未变,平衡正向移动,不可能是改变压强、改变某一物质的浓度,也不可能是使用催化剂,应是改变温度,正反应为放热反应,降低温度平衡正向移动,故改变条件为:降低温度,
故答案为:降低温度.
点评 本题考查化学平衡计算与影响因素、化学平衡图象,侧重考查学生分析能力、读图获取信息能力,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | 将pH=2的盐酸与0.01 mo1•L-1氨水等体积混合:c(NH4+)=c (Cl-) | |
| C. | CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H 2C2O4)] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E五种短周期元素,其中A、B、C三元素在周期表中位置如下表所示.该三元素的原子序数之和为41.A和D的单质在不同条件下可以反应生成D2A(白色固体)和D2A2(淡黄色固体)两种化合物.E单质在C单质中燃烧时产生苍白色火焰,生成物的水溶液能使石蕊试液变红.
有A、B、C、D、E五种短周期元素,其中A、B、C三元素在周期表中位置如下表所示.该三元素的原子序数之和为41.A和D的单质在不同条件下可以反应生成D2A(白色固体)和D2A2(淡黄色固体)两种化合物.E单质在C单质中燃烧时产生苍白色火焰,生成物的水溶液能使石蕊试液变红.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 白格中都是主族元素,灰格中都是副族元素 | |
| B. | X和Z形成的化合物只有两种 | |
| C. | X、Y元素最高价氧化物对应的水化物酸性:X>Y | |
| D. | X、Y、Z的气态氢化物中最稳定的是:X的氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO4 溶液滴加过量的Ba(OH)2溶液H++SO${\;}_{4}^{2-}$+Ba2++OH-=BaSO4↓+H2O | |
| B. | 铁钉放入稀硫酸中2Fe+6H+=2Fe3++3H2↑ | |
| C. | 向沸水中滴入几滴饱和氯化铁溶液,并加热至溶液呈红褐色Fe3++3H2O Fe(OH)3↓+3H+ | |
| D. | 铜片与硝酸银溶液反应Cu+Ag+=Cu2++Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com