
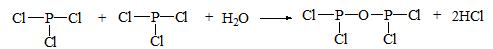
分析 (1)相对分子质量为153.5,其中氯元素的质量分数为0.694,计算所含氯原子的数目,结合磷的化合价被氧化为最高正价+5价分析和氧原子、氯原子结合形成的化合物的化学式;根据POCl3和氧气在高温下发生化学反应的方程式进行计算;
(2)根据元素守恒结合质量关系进行计算即可;
(3)根据得失电子守恒和元素守恒、公式c=$\frac{n}{V}$进行计算;
(4)形成1mol二聚体生成2molHCl,形成1mol三聚体生成4molHCl,二聚体与三聚体物质的量相同,据此计算.
解答 解:(1)PCl3可以被O2氧化生成一种无色透明的带刺激性臭味的液体X,相对分子质量为153.5,其中氯元素的质量分数为0.694,设含氯原子为x,则$\frac{35.5x}{153.5}$=0.694,x=3,PCl3可以被O2氧化,磷元素化合价升高为+5价,依据原子结合形成的化学键分析,除结合三个氯原子外,只能结合一个氧原子,依据元素化合价代数和为0写出化学式POCl3,符合相对分子质量.POCl3在高温与O2发生反应,形成P4O10(固态)和Cl2的方程式为:4POCl3+3O2=P4O10+6Cl2,将3.07g即0.02molX与448mL即0.02mol O2(已折算至标准状况,下同)在高温下充分反应后,POCl3全部反应,氧气有剩余,生成氯气的量按照POCl3进行计算,其物质的量是0.03mol,消耗氧气是0.025mol,剩余氧气是0.005mol,气体的体积将从0.02mol448mL变为0.005mol+0.03mol=0.035mol,体积是0.035mol×22.4L/mol=0.784L=784mL,
故答案为:POCl3;784;
(2)白磷在氯气中燃烧,设得到PCl3和PCl5的物质的量分别是x、y,则x+y=$\frac{2.48g}{31g/mol×4}$×4=0.08mol,137.5x+208.5y=14.550,解得x=0.03mol,y=0.05mol,则三氯化磷的质量分数=$\frac{0.03mol×137.5}{14.55}$×100%=28.35%=0.2835,故答案为:0.2835;
(3)①n[Ca(OH)2]=$\frac{15.725g}{74g/mol}$=0.2125 mol,P元素失电子,氧元素得电子,设氯化磷的物质的量是z,由得失电子守恒知:0.020mol×2(2-0)=z(5-3),解得z=n(PCl3)=0.04 mol,反应后溶液呈碱性,所以过量n[Ca(OH)2]=0.0125mol,反应掉0.2mol,0.04 mol PCl3和水反应会生成0.04 molH3PO4,0.12 molHCl,需Ca(OH)2 0.12mol.设PCl5xmol,生成x mol H3PO4,5x mol HCl,需4x mol Ca(OH)2,所以4x=0.2-0.12,x=0.02.所以Ca3(PO4)2为0.03mol,质量为9.300g,答:Ca3(PO4)2(已知式量310)沉淀的质量是9.300g;
②过量n[Ca(OH)2]=0.0125mol,c[Ca(OH)2]=$\frac{0.125mol}{2.5L}$=0.005 mol/L,c[CaCl2]=0.044 mol/L.
答:c[Ca(OH)2]=0.005 mol/L(1分);c[CaCl2]=0.044 mol/L.
(4)形成1mol二聚体生成2molHCl,形成1mol三聚体生成4molHCl;又因为二聚体与三聚体物质的量相同,则120molPCl3形成24mol二聚体和24mol三聚体,但由此形成的HCl应为2×24+4×24=144mol<160mol,故三聚体应包括环状结构,产物中n(P2OCl4?):n(P3O2Cl5):n(P3O3Cl3)=3:2:1,故答案为:n(P2OCl4?):n(P3O2Cl5):n(P3O3Cl3)=3:2:1.
点评 本题考查学生根据化学方程式的计算知识,注意守恒思想的应用是关键,难度较大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SiO3与SO2 | B. | Al2(SO4)3和 氨水 | C. | FeI2与Cl2 | D. | NaHCO3与Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2(SO4)3、(NH4)2SO4 | B. | NaAlO2、NH4Cl | C. | Al2(SO4)3、NH4Cl | D. | AgNO3、(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、C1O-、I- | B. | C1-、NO3-、Fe2+、Na+ | ||
| C. | K+、Ba2+、OH-、SO42- | D. | Fe3+、NH4+、Br-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78gNa2O2固体含有的离子数为4NA | |
| B. | 22.4L乙烯中含有的分子数为NA | |
| C. | 用惰性电极电解NaCl溶液,每生成agNaOH时,电路中通过的电子个数为aNA | |
| D. | 1molSiO2晶体中Si-O键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | x=0.4a,2Fe2++Cl2═2Fe3++2Cl- | |
| B. | x=0.6a,2Br-+Cl2═Br2+2Cl- | |
| C. | x=2a,2Fe2++2Br-+2Cl2═Br2+2Fe3++4Cl- | |
| D. | x=1.5a,2Fe2++4Br-+3Cl2═2Br2+2Fe3++6Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com