
| A. | Ba2+、NO3-、NH4+、Cl- | B. | K+、Ba2+、Cl-、SO42- | ||
| C. | Al3+、CO32-、NH4+、AlO2- | D. | Cu2+、NH4+、SO42-、K+ |
分析 A.四种离子能够共存,但加入氢氧化钠溶液后没有沉淀生成;
B.钡离子与硫酸根离子反应生成难溶物硫酸钡沉淀;
C.铝离子与碳酸根离子、偏铝酸根离子反应,铵根离子与偏铝酸根离子反应;
D.铵根离子与氢氧化钠加加热反应生成氨气,铜离子与氢氧化钠反应生成氢氧化铜沉淀.
解答 解:A.Ba2+、NO3-、NH4+、Cl-之间不反应,能够共存,但加入NaOH溶液后没有沉淀生成,故A错误;
B.Ba2+、SO42-之间反应生成硫酸钡沉淀,在溶液中不能大量共存,故B错误;
C.Al3+与CO32-、AlO2-发生双水解反应,NH4+、AlO2-之间发生反应,在溶液中不能大量共存,故C错误;
D.Cu2+、NH4+、SO42-、K+之间不反应,能够大量共存,加入NaOH溶液后,Cu2+与氢氧化钠反应生成氢氧化铜沉淀,NH4+与氢氧化钠加热生成氨气,满足条件,故D正确;
故选D.
点评 本题考查离子共存,题目难度中等,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
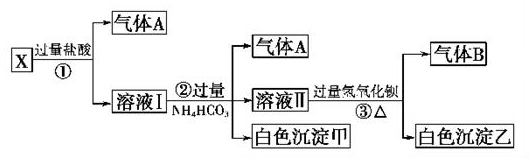
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
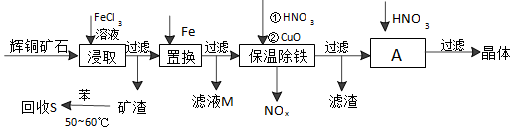
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{N}{{N}_{A}}$表示该气体的物质的量 | |
| B. | $\frac{M}{{N}_{A}}$表示该气体一个分子的质量 | |
| C. | $\frac{\frac{m}{N}}{\frac{1}{12}m(C)}$表示该气体的相对分子质量 | |
| D. | $\frac{m}{N}$表示该气体所含原子的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KAl(SO4)2═K++Al3++SO42- | B. | NaH2PO4═Na++H2PO4- | ||
| C. | H2S?2H++S2- | D. | NaClO═Na++Cl-+O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
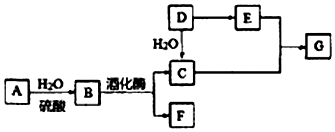
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
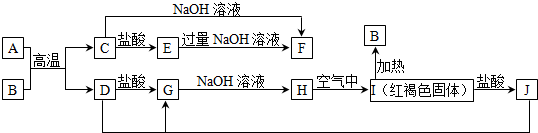
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
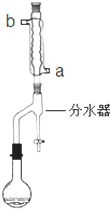 在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.实验步骤如下:
在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com