
分析 (1)设水的物质的量为100mol,则NaOH为5mol,根据m=nM计算水、NaOH的质量,进而计算溶液质量分数;
(2)根据n=$\frac{m}{M}$计算Mg2+的物质的量,再根据c=$\frac{n}{V}$计算Mg2+的物质的量浓度;
(3)因硫酸足量,则锌完全反应,根据Zn+H2SO4═ZnSO4+H2↑计算生成氢气、硫酸锌的物质的量,根据V=nVm计算氢气体积,根据c=$\frac{n}{V}$计算硫酸锌的浓度.
解答 解:(1)设水的物质的量为100mol,则NaOH为5mol,则水的质量为100mol×18g/mol=1800g、NaOH的质量为5mol×40g/mol=200g,故溶液质量分数为$\frac{200g}{1800g+200g}$×100%=10%,故答案为:10%;
(2)Mg2+的物质的量为$\frac{45.6×1{0}^{-3}g}{24g/mol}$=1.9×10-3mol,溶液体积为1L,则Mg2+的物质的量浓度为1.9×10-3mol/L,故答案为:1.9×10-3mol/L;
(3)解因硫酸足量,则锌完全反应,锌的物质的量为$\frac{6.5g}{65g/mol}$=0.1mol,
设生成氢气的物质的量为x,硫酸锌的物质的量为y,则:
Zn+H2SO4═ZnSO4+H2↑
1 1 1
0.1mol y x
则x=y=0.1mol
①生成标准状况下的H2的体积为0.1mol×22.4L/mol=2.24L,故答案为:2.24L;
②所得溶液中硫酸锌的物质的量浓度是$\frac{0.1mol}{0.08L}$=1.25mol•L-1,故答案为:1.25mol•L-1.
点评 本题考查溶液浓度有关计算、化学方程式计算,比较基础,有利于基础知识的巩固.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体都是均匀透明的液体 | |
| B. | 胶体粒子能透过半透膜而溶液不能 | |
| C. | 胶体与溶液的本质区别在于粒子直径的大小不同 | |
| D. | 利用丁达尔效应可区别浊液和胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
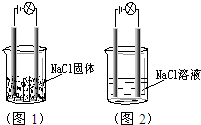 一化学兴趣小组在家中进行化学实验,按照图1连接 好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
一化学兴趣小组在家中进行化学实验,按照图1连接 好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )| A. | NaCl是非电解质 | |
| B. | 将图2中的NaCl溶液换成液态HCl,灯泡也亮 | |
| C. | 将图2中的NaCl溶液换成SO2的水溶液,灯泡也亮,说明SO2是电解质 | |
| D. | 电解质本身不一定能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2溶于水和H2SO3分解 | |
| B. | H2跟I2化合成HI和HI分解 | |
| C. | SO2跟O2化合成SO3和SO3分解 | |
| D. | 电解水生成H2与O2和H2与O2转化成H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 50ml盐酸 | 50ml盐酸 | 50ml盐酸 | |
| m(混合物) | 9.2g | 13.8g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
| A. | 13.8g混合物恰好能与50ml盐酸完全反应 | |
| B. | 根据表中数据不能计算出混合物中NaHCO3的质量分数 | |
| C. | 向50ml盐酸中加入混合物27.6g时,盐酸过量 | |
| D. | 盐酸的物质的量浓度为5.0mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com