
【题目】我国很早就使用青铜器,由于时间久远,其表面有一层“绿锈”,“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、CO2、O2作用产生的,化学式为[Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐、CO2和H2O。某同学利用以下反应实现了“铜→铜绿→……→铜”的转化。
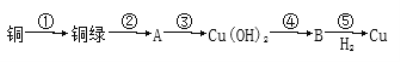
(1)从物质分类标准看,“铜绿”属于______(填字母)。
A.酸 B.碱 C.盐 D.氧化物
(2)写出B的化学式:____________。
(3)请写出铜绿与盐酸反应的离子方程式:________________________。
(4)上述转化过程中属于氧化还原反应的是_______________(填序号)
(5)铜绿在受热时可直接分解生成物质B、CO2和水,其分解的化学方程式为_____________。
【答案】C CuO Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑ ①⑤ Cu2(OH)2CO3=2CuO+H2O+CO2↑
【解析】
本题考查的知识点有物质的分类、离子方程式的书写、氧化还原反应。
①物质的分类方法很多,其中按物质的组成和性质特点可分为混合物和纯净物;纯净物分为单质和化合物;单质分为金属单质和非金属单质,化合物分为无机物和有机物;无机物分为氧化物、酸、碱、盐等;其中盐按组成可分为正盐、酸式盐、碱式盐、复盐,按是否溶于水可分为可溶性盐和难溶性盐。
②离子方程式书写时遵循一写二拆三删四查的原则。其中可溶性强电解质拆成离子形式;难溶物、单质、气体、氧化物、弱电解质、水不拆,保持化学式的形式。
③氧化还原反应的特征是有元素化合价的升降。
(1)铜绿是碱式碳酸铜的俗称,所以Cu2(OH)2CO3属于碱式盐。本小题答案为:C。
(2)氢氧化铜受热分解生成氧化铜和水,则B为氧化铜,化学式为CuO。本小题答案为:CuO。
(3)由信息可知“铜绿”能跟酸反应生成铜盐、CO2和H2O,则铜绿与盐酸反应的离子方程式为Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑。本小题答案为:Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑。
(4)反应①中铜转化为铜绿,铜元素的化合价由0价升高到+2价,有价态变化,反应①为氧化还原反应;反应②是铜绿与酸反应生成铜盐、CO2和H2O,是复分解反应,没有价态变化,不是氧化还原反应;反应③是铜盐与碱反应生成氢氧化铜沉淀,是复分解反应,没有价态变化,不是氧化还原反应;反应④是氢氧化铜受热分解生成氧化铜和水,是分解反应,没有价态变化,不是氧化还原反应;反应⑤是氧化铜与氢气反应生成铜和水,是置换反应,有价态变化,是氧化还原反应。本小题答案为:①⑤。
(5)铜绿在受热时可直接分解生成物质B、CO2和水,因为B为CuO,则铜绿受热分解的化学方程式为Cu2(OH)2CO3=2CuO+H2O+CO2↑。


科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①、过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应涉及H2O、Cr2O72―、NO2―、H+、NO3―、Cr3+六种微粒,已知反应过程中NO2-浓度变化如图所示,下列说法不正确的是
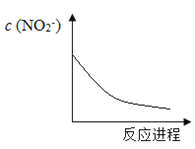
A. Cr2O72-中Cr化合价是+6价
B. 反应的氧化产物是NO3-
C. 消耗1mol氧化剂,转移电子6mol
D. 随着反应的进行,溶液中的H+ 浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氨酯类高分子材料PU用途广泛,其合成反应为:

下列说法不正确的是
A. HO(CH2)4OH的沸点高于CH3CH2CH2CH3
B. 高分子材料PU在强酸、强碱中能稳定存在
C. 合成PU的两种单体的核磁共振氢谱中均有3个吸收峰
D. 以1,3-丁二烯为原料,可合成HO(CH2)4OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3)以达到消除污染的目的。其工作原理的示意图如下:

下列说法不正确的是
A. Ir的表面发生反应:H2 + N2O == N2 + H2O
B. 导电基体上的负极反应:H2-2e == 2H+
C. 若导电基体上只有单原子铜,也能消除含氮污染物
D. 若导电基体上的Pt颗粒增多,不利于降低溶液中的含氮量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用含三价钒(V2O3)为主的某石煤为原料(含有Al2O3、CaO等杂质),钙化法焙烧制备V2O5,其流程如下:
![]()
【资料】:+5价钒在溶液中的主要存在形式与溶液pH的关系:
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 | VO2+ | VO3 | V2O74 | VO43 |
(1)焙烧:向石煤中加生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式是______。
(2)酸浸: ① Ca(VO3)2难溶于水,可溶于盐酸。若焙砂酸浸时溶液的pH=4,Ca(VO3)2溶于盐酸的离子方程式是______。
② 酸度对钒和铝的溶解量的影响如图所示:酸浸时溶液的酸度控制在大约3.2%,根据如图推测,酸浸时不选择更高酸度的原因是______。

(3)转沉:将浸出液中的钒转化为NH4VO3固体,其流程如下:
![]()
① 浸出液中加入石灰乳的作用是______。
② 已知CaCO3的溶解度小于Ca3(VO4)2。向Ca3(VO4)2沉淀中加入(NH4)2CO3溶液,可使钒从沉淀中溶出。结合化学用语,用平衡移动原理解释其原因:______。
③ 向(NH4)3VO4溶液中加入NH4Cl溶液,控制溶液的pH=7.5。当pH>8时,NH4VO3的产量明显降低,原因是______。
(4)测定产品中V2O5的纯度:
称取a g产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1 mL c1 mol·L1 (NH4)2Fe(SO4)2溶液(VO2+ + 2H+ + Fe2+ == VO2+ + Fe3+ + H2O)。最后用c2 mol·L1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2 mL。已知 MnO4被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是______。(V2O5的摩尔质量:182 g·mol1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3)以达到消除污染的目的。其工作原理的示意图如下:

下列说法不正确的是
A. Ir的表面发生反应:H2 + N2O == N2 + H2O
B. 导电基体上的负极反应:H2-2e == 2H+
C. 若导电基体上只有单原子铜,也能消除含氮污染物
D. 若导电基体上的Pt颗粒增多,不利于降低溶液中的含氮量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别将下列选项中的两种物质充分混合静置一段时间后,能分层的是( )
A.乙醇与乙酸B.乙醇与饱和Na2CO3溶液
C.乙酸乙酯与饱和Na2CO3溶液D.乙酸与水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com