
| A. | W在自然界只有一种核素 | |
| B. | 半径大小:X+<Y3+<Z- | |
| C. | Y与Z形成的化合物的水溶液呈弱酸性 | |
| D. | X的最高价氧化物对应的水化物为弱碱 |
分析 W、X、Y、Z为原子序数依次增大的短周期主族元素,W的原子核外只有6个电子,W为C元素;X+和Y3+的电子层结构相同,X为Na,Y为Al元素;Z的电子数比Y3+多8个,Z的电子数为10+8-1=17,Z为Cl,以此来解答.
解答 解:由上述分析可知,W为C,X为Na,Y为Al,Z为Cl,
A.W为C,存在12C、13C、14C等核素,故A错误;
B.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则半径大小:Y3+<X+<Z-,故B错误;
C.Y与Z形成的化合物为氯化铝,铝离子水解,其水溶液呈弱酸性,故C正确;
D.X的最高价氧化物对应的水化物为NaOH,为强碱,故D错误;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、原子结构来推断元素为解答的关键,侧重分析与应用能力的考查,注意短周期元素的限制条件及规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O═3I2+6OH- | |
| B. | FeSO4溶液中加入酸性H2O2溶液:Fe2++2H2O2+4H+═Fe3++4H2O | |
| C. | Cl2和水反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2═I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能用丁达尔效应可以区分Fe(OH)3胶体和FeCl3溶液 | |
| B. | 配制100g20%的硝酸钾溶液,不需要用到容量瓶 | |
| C. | 可以用酒精萃取的方法将溴从溴水中提取出来 | |
| D. | 焰色反应实验前,应先用稀硫酸洗净铂丝,再在酒精灯上灼烧至无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  实验室中常用图的原理制取少量的乙酸乙酯* | |
| B. |  图所示装置及现象验证了Na和水的反应是放热反应 | |
| C. |  利用图所示装置原理可以防止铁钉生锈 | |
| D. |  图中酸性KMnO4溶液颜色逐渐变浅可证明浓硫酸具有脱水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
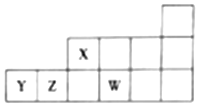
| A. | 原子半径:rW>rZ>rY>rX | |
| B. | 最高价氧化物对应水化物的酸性:Z>X>Y | |
| C. | X、Z、W形成的简单氢化物中X的氢化物沸点最高 | |
| D. | W与Y元素形成的化合物在水溶液中能稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的盐酸与pH=11的氨水等体积混合后,溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 升高NH4Cl溶液的温度,其水的离子积常数和pH均增大 | |
| C. | 反应2Mg(s)+CO2(g)═C(s)+2MgO(s)能自发进行,则该反应的△H>0 | |
| D. | 常温下0.1mol/L的Na2A溶液pH=10,该溶液中水电离的c(OH-)=10-10mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①:可用于吸收NH3,并防止倒吸 | |
| B. | 装置②:验证溴乙烷发生消去反应生成烯烃 | |
| C. | 装置③:观察原电池装置中电流表指针偏转 | |
| D. | 装置④:由实验现象推知酸性强弱顺序为CH3COOH>H2CO3>C6H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应6 NaBH4+2 FeCl3+18 H2O═2 Fe+6 NaCl+6 H3BO3+21H2↑可制纳米铁,该反应中每生成1 mol Fe,转移的电子数目为3NA | |
| B. | 标准状况下,22.4 L甲醇完全燃烧后生成的CO2分子数为 NA | |
| C. | 1mol氯气与过量铁反应,转移的电子数为 3NA | |
| D. | 30g甲酸甲酯与葡萄糖的混合物中含有的原子数为 4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com