
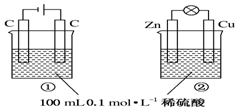
| A. | 硫酸浓度变化:①增大,②减小 | |
| B. | 装置名称:①是原电池,②是电解池 | |
| C. | 电极反应式:①中阳极:4OH--4e-═2H2O+O2↑②中正极:Zn-2e-═Zn2+ | |
| D. | 离子移动方向:①中H+向阴极方向移动,②中H+向负极方向移动 |
分析 由图可知,①为电解池,②为原电池,①中电解水,②中Zn与氢离子反应,且原电池中阳离子向正极移动,电解池中阳离子向阴极移动,以此来解答.
解答 解:A.①中电解水,②中Zn与氢离子反应,则c(H+)浓度变化:①增大,②减小,故A正确;
B.由装置根据是否有外加电源可知:①是电解池,②是原电池,故B错误;
C.电极反应式:①中阳极发生氧化反应为2H2O-4e-=4H++O2↑,②中负极发生氧化反应为Zn-2e-=Zn2+,故C错误;
D.原电池中阳离子向正极移动,电解池中阳离子向阴极移动,则①中H+向阴极方向移动,②中H+向正极方向移动,故D错误;
故选A.
点评 本题考查原电池和电解池,为高频考点,把握装置的判断、电极、电极反应为解答的关键,侧重分析与应用能力的考查,注意原电池及电解池的工作原理,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 明矾易水解生成胶体,可用作净水剂 | |
| B. | 晶体硅熔点高硬度大,可用作芯片 | |
| C. | 氮气化学性质稳定,可用作粮食保护气 | |
| D. | 溴化银见光易分解,可用作胶片感光剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol
在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol| A. | 该密闭容器的体积为1 L | |
| B. | 从反应开始到平衡,氢气的转化率为0.75 | |
| C. | 从反应开始到平衡,氢气的平均反应速率为0.075 mol/(L•min) | |
| D. | 该温度下,反应的平衡常数的值为$\frac{16}{3}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
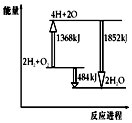
| A. | 拆开2molH2(g)和1molO2(g)中的化学键共吸收1368kJ能量 | |
| B. | 由H、O原子形成2molH2O(g),共放出1852kJ能量 | |
| C. | 1molH2(g)和$\frac{1}{2}$molO2(g)反应生成1molH2O(l),放出热量小于242kJ | |
| D. | 2molH2(g)和1molO2(g)反应生成2molH2O(g),共放出484kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3═H++N5++3O2- | B. | Ca(OH)2═Ca2++(OH-)2 | ||
| C. | AlCl3═Al+3+3Cl- | D. | Al2(SO4)3═2Al3++3SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol•L-1 | B. | 1 mol•L-1 | C. | 0.67 mol•L-1 | D. | 0.55 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,任何气体的摩尔体积都约为22.4 L | |
| B. | 1 mol气体的体积若是22.4 L,它必定处于标准状况 | |
| C. | 标准状况下,1molH2和O2混合气体的体积约为22.4 L | |
| D. | 标准状况下,11.2L水中含有分子的数目为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com