
下列实验装置或操作(已略去部分夹持仪器)正确的是( )
|
| A. |
配置溶液 | B. |
实验室制乙烯 | C. |
制备Fe(OH)2 | D. |
制备与收集氨气 |
| 化学实验方案的评价. | |
| 专题: | 实验评价题. |
| 分析: | A.玻璃棒的下端应在刻度线以下,且加水至刻度线1~2cm应改用胶头滴管定容; B.用浓硫酸、乙醇共热到约170℃制乙烯; C.氢氧化亚铁极易被氧气氧化; D.收集氨气应利用向下排空气法. |
| 解答: | 解:A.玻璃棒的下端应在刻度线以下,图中玻璃棒下端在刻度线以上,且加水至刻度线1~2cm应改用胶头滴管定容,故A错误; B.用浓硫酸、乙醇共热到约170℃制乙烯,温度计应插入液面以下,故B错误; C.氢氧化亚铁不稳定,容易被空气中的氧气氧化生成红褐色的氢氧化铁,应隔绝空气制取,故C正确; D.收集氨气应利用向下排空气法,图中收集氨气时导管应伸到小试管的底部,故D错误; 故选C. |
| 点评: | 本题考查化学实验方案的评价,为高频考点,涉及溶液的配制、物质制备及氨气的制备实验等,把握实验基础知识和装置图的作用为解答的关键,注意实验的评价性、操作性分析,题目难度不大. |


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
下列实验对应的结论不正确的是
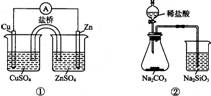
A.①能组成Zn-Cu原电池 B.②能证明非金属性Cl>C>Si
C.③能说明2NO2 N2O4 △H<0 D.④中自色沉淀为BaSO4
N2O4 △H<0 D.④中自色沉淀为BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是( )
|
| A. | 铁制品上电镀锌时,理论上电镀液ZnCl2需要不断更换 |
|
| B. | 钢铁设备与外加直流电源的正极相连可以防止钢铁腐蚀 |
|
| C. | 甲烷燃料(KOH)电池的正极反应为:O2+2H2O+4e﹣=4OH﹣ |
|
| D. | 粗铜精炼过程中,电路中每通过2mol电子,阳极就会溶解64g铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
电化学与生产生活密切相关.请运用相关知识回答下列问题:
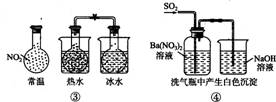
(1)如图1为某同学设计的装置,用石墨作电极电解饱和氯化钠溶液制备家用环保型消毒液(NaClO溶液)发生器.
若通电时,为使生成的Cl2被完全吸收,制得有较强杀菌能力的消毒液,
则电源的a电极名称为 极(填“正”、“负”、“阴”或“阳”),
装置溶液中反应生成NaClO的离子方程式为: .
(2)该消毒液还具有的化学性质是 (填序号).
A.强氧化性 B.强还原性 C.不稳定性 D.漂白性E.弱酸性
(3)设计方案,对该消毒液对碳钢制品的腐蚀原理实施探究.
①用烧杯取少量样品,将一颗光亮的普通碳钢钉放入烧杯,浸泡一段时间.预期的实验现象是 .
②为了进一步探究铁钉在该漂白剂(NaClO)溶液中的腐蚀原理,现设计了如图2实验装置,请写出碳(C)极上发生的电极反应式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
若需通过导电实验证明NaCl是离子化合物,可以选择的实验对象是( )
|
| A. | NaCl固体 | B. | NaCl水溶液 | C. | NaCl熔融液 | D. | 以上都不可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将10mL 0.2mol/L的一元酸HA与V mL等浓度的NaOH溶液混合.当V=10mL时,所得溶液中部分微粒组成及浓度如图所示.假设溶液体积可以相加,则下列说法正确的是( )
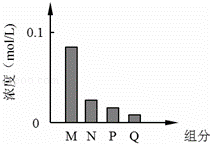
|
| A. | 图中N表示HA,P表示OH﹣,Q表示H+ | B. | 若V=10 mL,则pH=7 |
|
| C. | 若V<10 mL,则溶液显酸性 | D. | 若V=10 mL,则:c(M)+c(P)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.
(1)与氯元素同族的短周期元素的原子结构示意图为 .
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:NaCl溶液 NaClO3溶液
NaClO3溶液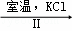 KClO3晶体
KClO3晶体
①完成Ⅰ中反应的总化学方程式: NaCl+ 3 H2O═ NaClO3+ .
②Ⅱ中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其他晶体析出的原因是 .
(4)一定条件下,在水溶液中1mol Cl﹣、ClOx﹣(x=1,2,3,4)的能量(kJ)相对大小如图所示.
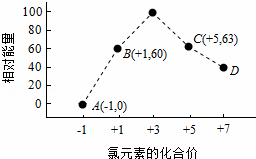
①D是 (填离子符号).
②B→A+C反应的热化学方程式为 (用离子符号表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
丙酮醛(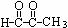 )是重要的制药中间体,如果以2-溴丙烷为初始原料,通过多步反应制得。需要经过的反应依次是( )
)是重要的制药中间体,如果以2-溴丙烷为初始原料,通过多步反应制得。需要经过的反应依次是( )
A.取代-氧化-加成-消去 B.消去-取代-加成-氧化
C.消去-加成-取代-氧化 D.取代-消去-加成-氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
I:常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①、②、③的实验,实验数据记录如下表
| 序号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
请回答:(1)根据①组实验情况,分析混合溶液的pH=9的原因是_________________。
(用反应的离子方程式表示),在该溶液中下列关系式不正确的是(填序号字母)________。
A.c(Na+)+c(H+)=c(OH-)+c(A-) B.c(Na+)=c(HA)+c(A-)
C.c(HA)+c(H+)=c(OH-) D.c(Na+)+c(H+)=c(OH-)+c(A-)+c(HA)
(2)②组情况表明,c 0.2mol·L-1(选填“>”、“<”或“=”)。混合溶液中离子浓度
c(A-)_____c(Na+)(选填“>”、“<”或“=”)从③组实验结果分析,说明HA的电离程度________NaA的水解程度(选填“>”、“<”或“=”)。
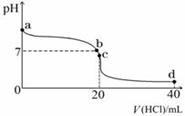 Ⅱ:室温下,若将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。 (1)NH3·H2O的电离方程式是 。
Ⅱ:室温下,若将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。 (1)NH3·H2O的电离方程式是 。
(2)b点所示溶液中的溶质是 。
(3)c点所示溶液中,离子浓度从大到小的关系为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com