
| A. | 由W与X组成的化合物的沸点总高于由W与Y组成的化合物的沸点 | |
| B. | 以上四种元素的原子半径大小为W<X<Y<Z | |
| C. | W、X、Y、Z原子的核外最外层电子数的总和为23 | |
| D. | W 与 Y 可形成离子化合物 |
分析 短周期主族元素W、X、Y和Z的原子序数依次增大.Z元素无正化合价,则Z为F元素.其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同,则W为H元素.X是形成化合物种类最多的元素,X为C元素;Y的最简单氢化物与Cl2混合后产生白烟,Y为N元素,白烟为氯化铵,然后结合元素化合物知识来解答.
解答 解:短周期主族元素W、X、Y和Z的原子序数依次增大.Z元素无正化合价,则Z为F元素.其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同,则W为H元素.X是形成化合物种类最多的元素,X为C元素;Y的最简单氢化物与Cl2混合后产生白烟,Y为N元素,
A.由W与X组成的化合物的沸点可能低于由W与Y组成的化合物的沸点,如甲烷的沸点低于氨气的沸点,氨气中含氢键,故A错误;
B.电子层越多,原子半径越大,同周期原子序数大的原子半径小,则以上四种元素的原子半径大小为W<Z<Y<X,故B错误;
C.W、X、Y、Z原子的核外最外层电子数的总和为1+4+5+7=17,故C错误;
D.W 与 Y 可形成离子化合物,如铵盐中含N、H元素,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素化合物知识推断元素为解答的关键,侧重分析与应用能力的考查,注意F无正价,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 试剂 | 主要操作 |
| A | 乙炔 | H2S、PH3 | NaOH溶液 | 洗气 |
| B | 乙醛 | 乙酸 | Na2CO3溶液 | 分液 |
| C | 溴乙烷 | 溴单质 | NaHSO3溶液 | 分液 |
| D | CH3CH2OH | H2O | 熟石灰 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 正极反应为Ag-e-=Ag+ | |
| B. | 放电时,交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 用KCl溶液代替盐酸,则电池总反应不改变 | |
| D. | 当电路中转移0.1mol e-时,通过交换膜的阳离子为0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
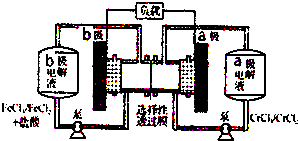
| A. | 氧化性:Cr3+>Fe3+ | |
| B. | 电池充电时,b极的电极反应式为Fe3++e-═Fe2+ | |
| C. | a、b电极材料均可以用碳棒或铜片 | |
| D. | 电池放电时,a极c(Cl-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7,则滤液中: c(H+)+c(NH4+)═c(OH-)+c(HCO3-)+2c(CO32-) | |
| B. | 40℃时,在氨水体系中不断通入CO2,随着CO2的通入,$\frac{c(OHˉ)}{c(NH3•H2O)}$不断增大 | |
| C. | 室温下,将0.05mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入0.05molCaO,所得溶液中$\frac{c(O{H}^{-})}{c(HC{O}_{3}^{-})}$增大 | |
| D. | 为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | ⑤ | ||||
| 三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
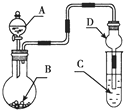
| A. | 若A为浓盐酸,B为KMnO4晶体,C是紫色石蕊溶液,则C中溶液最终呈红色 | |
| B. | 若A为浓硫酸,B为Na2SO3固体,C中是NaOH溶液,实验仪器D可以起到防止溶液倒吸的作用 | |
| C. | 若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液先产生白色沉淀后沉淀又溶解 | |
| D. | 若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
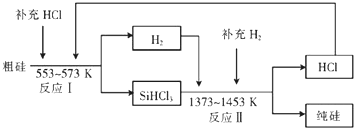
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com