
| A、含有大量[Al(OH)4]-的溶液中:Na+、OH-、Cl-、CO32- | ||
B、常温下
| ||
| C、能使pH试纸显红色的溶液中:Na+、ClO-、Fe2+、SO42- | ||
| D、能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- |
| c(H+) |
| c(OH-) |
| c(H+) |
| c(OH-) |


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
| A、CH3COOH溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) |
| B、0.1 mol/L的CH3COOH溶液加水稀释,溶液中离子浓度均减小 |
| C、CH3COOH溶液中加入少量NaHCO3固体,PH增大 |
| D、常温下,0.1 mol/L的CH3COOH溶液与0.01 mol/L的CH3COOH溶液中的c(H+)之比小于10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、对“地沟油”进行分馏可得到汽油 |
| B、向煤中加入适量CaSO4,可大大减少燃烧产物中SO2的量 |
| C、PM2.5、二氧化碳都属于空气质量日报的内容 |
| D、误食可溶性重金属盐后,应采取的有效应急措施是喝大量的豆浆或牛奶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液④显碱性,用离子方程式解释其原因可表示成:CO32-+2H2O?H2CO3+2OH- |
| B、在上述四种溶液中,pH由大到小的顺序为:②④①③ |
| C、将该温度下a mL的溶液②与b mL的溶液③混合,所得混合溶液的pH=7,则a:b=1:2 |
| D、若将溶液④和Al2(SO4)3溶液混合,一定可观察到有白色胶状沉淀和无色气体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(OH-) |
| A、该溶液中由水电离出的c(H+)=l×10-13mol/L |
| B、由pH=4的HA与pH=10的NaOH溶液等体积混合,溶液中c(Na+)>c(A-)>c(OH-)>c(H+) |
| C、浓度均为0.1mol/L的HA和NaA溶液等体积混合,若溶液呈酸性,则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-) |
| D、0.1mol?L-1 HA溶液与0.05mol?L-1 NaOH溶液等体积混合后所得溶液中c(H+)+c(Na+)=c(OH-)+c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
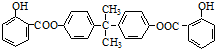
查看答案和解析>>
科目:高中化学 来源: 题型:
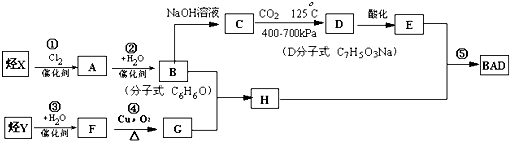
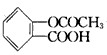 ,其分子式为
,其分子式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 放电 |
| A、PbSO4的氧化性比PbO2的强、还原性比Pb的强 |
| B、放电时,PbO2为氧化剂、做负极,Pb为还原剂、做正极 |
| C、放电时,当有2mol H2SO4反应时,会有1.204×1024个电子从铅电极流出 |
| D、充电时,PbSO4既被氧化又被还原,Pb是阳极产物之一 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com