
分析 (1)加入含有铵根离子的物质能抑制一水合氨电离且溶液中c(NH4+)增大,加入和OH-反应的物质能促进一水合氨电离,且溶液中c(NH4+)增大,但溶液的pH减小;
(2)加入含有OH-的物质能抑制一水合氨电离,且溶液中c(OH-)增大;
(3)加入浓氨水或升高温度,溶液中c(NH4+)及溶液的pH都增大;
(4)加水稀释能促进一水合氨电离,但溶液中c(NH4+)、c(OH-)都减小.
解答 解:(1)加入含有铵根离子的物质能抑制一水合氨电离且溶液中c(NH4+)增大,加入和OH-反应的物质能促进一水合氨电离,且溶液中c(NH4+)增大,但溶液的pH减小,符合条件的有氯化铵晶体、浓醋酸、少量FeCl3晶体,故答案为:CDF;
(2)加入含有OH-的物质能抑制一水合氨电离,且溶液中c(OH-)增大,溶液的pH增大,符合条件的为NaOH,故答案为:E;
(3)加入浓氨水或升高温度,溶液中c(NH4+)及溶液的pH都增大,则符合条件的有AG,故答案为:AG;
(4)加水稀释能促进一水合氨电离,但溶液中c(NH4+)、c(OH-)都减小,所以溶液的pH减小,则符合条件的为B,故答案为:B.
点评 本题考查弱电解质的电离,为高频考点,侧重考查学生分析判断能力,明确弱电解质电离影响因素是解本题关键,注意:加水稀释促进一水合氨电离但一水合氨电离增大程度小于溶液体积增大程度导致溶液中除了c(H+)外所有离子浓度都减小,为易错点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中碳原子不在一条直线上 | B. | 比丁烷更易液化 | ||
| C. | 1mol丙烷完全燃烧需消耗氧气5mol | D. | 光照下能够发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
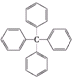 .对该分子的描述正确的是( )
.对该分子的描述正确的是( )| A. | 分子式为C25H20 | B. | 其不是芳香烃 | ||
| C. | 所有碳原子都在同一平面上 | D. | 该物质为脂环烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
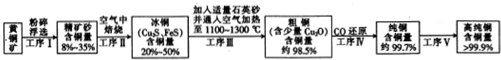
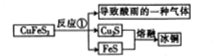
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 | |
| B. | 分子式是C3H8O的所有同分异构体共3种 | |
| C. | 用乙醇和浓H2SO4制备乙烯时,不可用水浴加热控制反应的温度 | |
| D. | 迷迭香酸结构如图: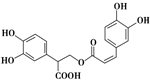 1 mol 迷迭香酸最多能和含6 mol NaOH的水溶液完全反应 1 mol 迷迭香酸最多能和含6 mol NaOH的水溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (3a+b) mol | B. | (3a+0.5b-3.5c) mol | ||
| C. | ( 3a+b+3.5c) mol | D. | (3a+0.5b) mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定互为同分异构体 | B. | 一定互为同系物 | ||
| C. | 实验式一定相同 | D. | 只能是同种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氯元素的单质及其化合物在生产生活中都很重要.回答下列问题:
氯元素的单质及其化合物在生产生活中都很重要.回答下列问题: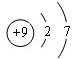 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com