
【题目】科学家研究发现药物肉桂硫胺(M)可能对2019-nCoV有效,是抗击新型冠状病毒潜在用药,以芳香烃A为原料,合成肉桂硫胺路线如图:
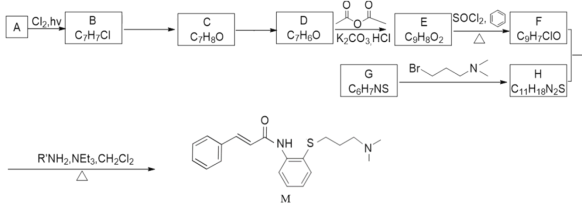
已知: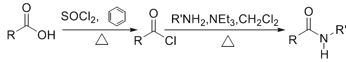
回答下列问题:
(1)A的名称为___。B→C的试剂和条件为__。
(2)C中含有的官能团名称为__。
(3)有机物D与新制的Cu(OH)2悬浊液加热煮沸产生砖红色沉淀的化学方程式是__。
(4)E反式结构简式为__,F最多有__个原子共平面。
(5)G→H的化学方程式为__,G→H的反应类型为__。
(6)J是E的同分异构体,满足下列条件的J的结构有___种;
①J能与溴水发生加成反应②J水解产物遇到FeCl3溶液显紫色
其中苯环上有两种化学环境的氢的结构简式为__。
【答案】甲苯 强碱的水溶液加热 羟基 C6H5CHO+2Cu(OH)2+NaOH![]() C6H5COONa+Cu2O↓+3H2O
C6H5COONa+Cu2O↓+3H2O ![]() 18
18  +HBr 取代反应 4
+HBr 取代反应 4 ![]()
【解析】
芳香烃A在光照情况下,与氯气反应生成了C7H7Cl,即A为甲苯,B为C6H5-CH2Cl,氯代烃发生取代,生成C,分子式为C6H5-CH2OH,氧化后生成D苯甲醛。由题目资料可知,E与SOCl2反应,取代羧基中的-OH为氯原子,即E含有羧基,分子式比D多2个碳原子,即E可能为![]() ,F为C6H5-CH=CHCOCl;根据逆推法,G为邻位双取代的苯环结构,取代基为-SH和-NH2,G发生取代反应生成H,-SH取代基转化为-S-CH2CH2CH2N(CH3)2,最终H和F生成M。
,F为C6H5-CH=CHCOCl;根据逆推法,G为邻位双取代的苯环结构,取代基为-SH和-NH2,G发生取代反应生成H,-SH取代基转化为-S-CH2CH2CH2N(CH3)2,最终H和F生成M。
(1)根据结构,A的名称为甲苯。B→C的反应为氯代烃的水解,试剂和条件为强碱的水溶液加热。
(2)C为苯甲醇,含有的官能团名称为羟基。
(3)有机物D为苯甲醛,与新制的Cu(OH)2悬浊液加热煮沸产生砖红色沉淀的化学方程式是C6H5CHO+2Cu(OH)2+NaOH![]() C6H5COONa+Cu2O↓+3H2O。
C6H5COONa+Cu2O↓+3H2O。
(4)E含有碳碳双键,E反式结构简式为![]() ,F 为C6H5-CH=CHCOCl,苯环为平面结构,其上原子全部共平面,碳碳双键为平面结构,与之相连的原子共平面,碳氧双碱为平面结构,与之相连的原子共平面,故最多有18个原子共平面。
,F 为C6H5-CH=CHCOCl,苯环为平面结构,其上原子全部共平面,碳碳双键为平面结构,与之相连的原子共平面,碳氧双碱为平面结构,与之相连的原子共平面,故最多有18个原子共平面。
(5)G→H的化学方程式为 +HBr,G→H的反应类型为取代反应。
+HBr,G→H的反应类型为取代反应。
(6)J是E的同分异构体,①J能与溴水发生加成反应,说明含有碳碳双键;②J水解产物遇到FeCl3溶液显紫色,说明水解产物含有酚羟基,原结构为酯,则满足结构的同分异构体有4种,分别为![]() 、
、![]() 、
、![]() 、C6H5-OOC-CH=CH2,其中苯环上只有两种化学环境的氢原子的结构简式为
、C6H5-OOC-CH=CH2,其中苯环上只有两种化学环境的氢原子的结构简式为![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列关于价电子构型3s23p4的描述正确的是( )
A. 它的元素符号为O
B. 它的核外电子排布式为1s22s22p63s23p4
C. 常温下,可以与H2化合生成液态化合物
D. 其电子排布图为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124形式存在于溶液中。“废渣2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124![]() R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热10.0g碳酸钠和碳酸氢钠的混合物至质量不再变化,剩余固体的质量为8.45g,求混合物中碳酸钠的质量分数。( )
A. 58% B. 42% C. 36% D. 64%
查看答案和解析>>
科目:高中化学 来源: 题型:
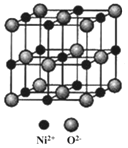
【题目】钢化玻璃因其优良的性能广泛应用于日常生活,但由于制作玻璃时里面含有极少量硫化镍,使得钢化玻璃在极限条件下的使用受到限制。
(1)基态硫原子价层电子的轨道表达式![]() 电子排布图
电子排布图![]() 为__,基态镍原子中核外电子占据最高能层的符号为__。
为__,基态镍原子中核外电子占据最高能层的符号为__。
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为__晶体,Ni(CO)4空间构型与甲烷相同,中心原子的杂化轨道类型为__,写出与配体互为等电子体的阴离子__![]() 任写一种
任写一种![]() 。
。
(3)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱__>__![]() 填化学式
填化学式![]() ,理由是__。
,理由是__。
(4)H2S的键角__填“大于”“小于”“等于”)H2O的键角,请从电负性的角度说明理由__。
(5)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的__空隙中,已知Ni2+半径为69nm,O2-半径为140nm,阿伏伽德罗常数为NA,NiO晶体的密度为__g/cm3(只列出计算式![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是十分重要的自然资源.如图是海水资源利用的部分过程,下列有关说法错误的是
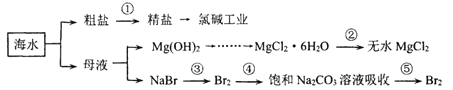
A.第①步除去粗盐中的 Ca2+、Mg2+、SO42-等杂质离子加入试剂顺序为:NaOH 溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
B.第②步由MgCl26H2O在空气中受热分解来制取无水MgCl2
C.第③步可通入Cl2,第④⑤步的目的是富集溴元素
D.海水淡化的方法主要有蒸馏法、电渗析法和离交换法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1)
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1)
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,达到平衡时n(CO2)=0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.若温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年4月23日,中国人民军成立70周年。提到海军就不得不提航空母舰,我国正在建造第三艘航空母舰。航母的龙骨要耐冲击,甲板要耐高温,外壳要耐腐蚀.
(1)镍铬钢抗腐蚀性能强,基态C r 原子价层电子的电子排布式为_______________。
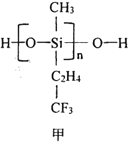
(2)航母甲板涂有一层耐高温的材料聚硅氧烷(结构如图申所示)。基态Si原子电子占据最高能级的电子云轮廓图为_______形:H、C、O、Si 四种元素中的电负性最高的是______。
(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①钛卤化物的熔点如下表所示:
TiF4 | TiCl4 | TiBr4 | TiI4 | |
熔点/℃ | 377 | -24 | 38 | 150 |
解释表中卤化物之间熔点差异的原因是________________________。
②OF2的空间构型为___________,其中O原子杂化方式为__________杂化。
③氯元素可以形成多种含氧酸,其酸性由弱到强的顺序为:HClO <HClO2<HClO3<HClO4。试解释其酸性强弱的原因是_______________ 。
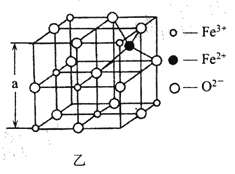
(4)海底金属软泥是在海洋底覆盖着的一层红棕色沉积物,蕴藏大着极的资源,含有硅、氧、锰、锌等。如图是从铁氧体离子晶体Fe3O4 中取出的能体现其晶体结构的一个立方体。
①晶体中的氧离子是否构成了面心立方最密堆积?________(填“是”或“否”);
②已知:Fe3O4 晶体的密度为5. 18gcm -3, 根据该图计算a________nrn (写出计算式即可,阿伏加德罗常数的值为N A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种优良的消毒剂,浓度过高时易发生分解,为了运输和贮存便利常将其制成
是一种优良的消毒剂,浓度过高时易发生分解,为了运输和贮存便利常将其制成![]() 固体,模拟工业上用过氧化氢法制备
固体,模拟工业上用过氧化氢法制备![]() 固体的实验装置如图所示。
固体的实验装置如图所示。
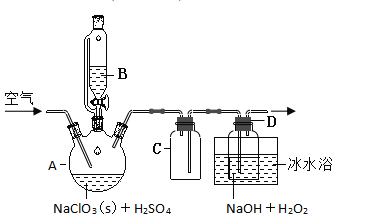
已知:![]() 熔点-59℃、沸点11℃、
熔点-59℃、沸点11℃、![]() 沸点150℃
沸点150℃
![]() 中的化学方程式:
中的化学方程式:![]()
(1)![]() 放入仪器
放入仪器![]() 中,仪器
中,仪器![]() 中的药品是__________(写化学式)。如果仪器
中的药品是__________(写化学式)。如果仪器![]() 改成分液漏斗,实验过程中可能会出现的实验现象__________。
改成分液漏斗,实验过程中可能会出现的实验现象__________。
(2)![]() 装置有明显缺陷,请绘出合理的装置图(标明气流方向)__________。
装置有明显缺陷,请绘出合理的装置图(标明气流方向)__________。
(3)向![]() 装置中通入空气,其作用是赶出
装置中通入空气,其作用是赶出![]() ,然后通过
,然后通过![]() 再到
再到![]() 中反应。通空气不能过快的原因是__________,通空气也不能过慢原因是__________。
中反应。通空气不能过快的原因是__________,通空气也不能过慢原因是__________。
(4)冰水浴冷却的目的是__________。
a.降低![]() 的溶解度 b.减少
的溶解度 b.减少![]() 的分解 c.使
的分解 c.使![]() 变为液态 d.加快反应速率
变为液态 d.加快反应速率
(5)写出![]() 中发生反应的化学方程式__________,
中发生反应的化学方程式__________,![]() 在反应起到__________作用。假设在反应中消耗掉
在反应起到__________作用。假设在反应中消耗掉![]() 则有__________
则有__________![]() 电子转移。
电子转移。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com