
| A. | 石油分馏 | B. | 煤的气化 | C. | 煤的干馏 | D. | 海水提溴 |
分析 化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化与物理变化的本质区别是有无新物质生成.
解答 解:A.石油分馏是将石油分离几种不同沸点的混合物的一种方法,属于物理变化,故A正确;
B.煤的气化是碳与水蒸气反应生成H2、CO的过程,属于化学变化,故B错误;
C.煤干馏可以得到煤焦油,煤焦油中含有甲烷、苯和氨等重要化工原料,属于化学变化,故C错误;
D.海水提溴时,要用氯气把海水中的溴离子置换成为单质溴,发生的是化学变化,故D错误;
故选A.
点评 本题考查物理变化与化学变化的区别与联系,难度不大,掌握化石燃料的综合利用是解题关键,解答时要分析变化过程中是否有新物质生成.


科目:高中化学 来源: 题型:推断题
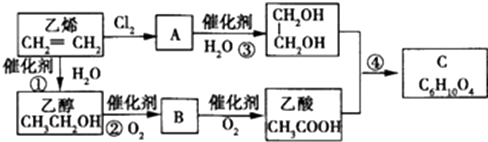
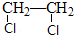 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 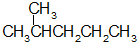 和 和 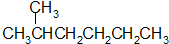 | |
| B. | H2N-CH2-COOH 和 H3C-CH2-NO2 | |
| C. | CH3-CH2-CH2-COOH 和 H3C-CH2-CH2-CH2-COOH | |
| D. | H3C-CH2-O-CH2-CH3和 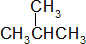 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
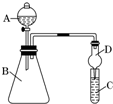 某同学利用如图装置来验证同主族元素非金属性的变化规律.
某同学利用如图装置来验证同主族元素非金属性的变化规律.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若R(OH)n为强碱,W(OH)n+1也为强碱 | |
| B. | 若HnXO${\;}_{{m}_{\;}}$为强酸,则Y是活泼非金属元素 | |
| C. | 若Y的最低化合价为-2,则Z的最高正化合价为+6 | |
| D. | 若X的最高正化合价为+5,则五种元素都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
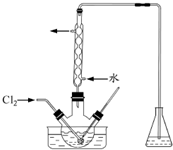 实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com