
已知Ca3(PO4)2与SiO2、C高温共热可以反应得到CaSiO3、P4蒸气和CO。完成下列填空:
(1)该反应中氧化剂是_________,氧化产物是_________。
(2)写出该反应的化学方程式____________________________________________。
(3)每消耗24.0g碳时,有 mol电子发生转移,生成P4_______g。
(4)反应所得混合气体,折算成标况下,其气体密度为 g/L。
(1)Ca3(PO4)2,CO。(1分×2)
(2)2Ca3(PO4)2+6SiO2+10C 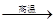 6CaSiO3+P4↑+10CO↑ (2分)
6CaSiO3+P4↑+10CO↑ (2分)
(3)4,24.8。 (1分×2)
(4)1.64(2分)
【解析】
试题分析:(1)P元素由+5价降低为0价,所以氧化剂为Ca3(PO4)2,C由0价升高为+2价,故CO为氧化产物。
(2)题干已给出反应物和生成物,配平即得化学方程式。
(3)n(e‾)=24.0g÷12g/mol×2=4mol;m(P4)=1/10n(C)×m=1/10×2mol×124g/mol=24.8g
(4)先求出平均摩尔质量:根据化学方程式设P4 1mol,CO10mol,根据M=(1mol×124g/mol+10mol×28g/mol)÷11mol=36.7g/mol,然后求出密度=36.7g/mol÷22.4L/mol=1.64g/L。
考点:本题考查氧化还原反应及其计算、化学方程式的书写。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源:三点一测丛书 高中化学(选修)化学反应原理 江苏版课标本 江苏版课标本 题型:013
|
如果已知Ca3(PO4)2的Ksp,则在其饱和溶液中,c(Ca2+)是 | |
| [ ] | |
A. |
(Ksp)1/5 mol·L-1 |
B. |
( |
C. |
( |
D. |
( |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)FeI2溶液中通入少量Cl2及过量Cl2时反应的离子方程式。
少量Cl2:______________________________________________________。
过量Cl2:______________________________________________________。
(2)已知Ca3(PO4)2、CaHPO4均不溶于水,且Ca3(PO4)2的溶解度比CaHPO4的溶解度小。将0.05 mol·L-1 Ca(H2PO4)2溶液与0.15 mol·L-1 NaOH溶液等体积混合,搅拌后静置,充分进行反应。请写出反应的离子方程式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)FeI2溶液中通入少量Cl2及过量Cl2时反应的离子方程式。
少量Cl2:____________________________________________。
过量Cl2:____________________________________________。
(2)已知Ca3(PO4)2、CaHPO4均不溶于水,且Ca3(PO4)2的溶解度比CaHPO4的溶解度小。将0.05 mol·L-1 Ca(H2PO4)2溶液与0.15 mol·L-1 NaOH溶液等体积混合,搅拌后静置,充分反应。请写出反应的离子方程式:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com