
| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 混合溶液的pH |
| I | 0.2 | 0.2 | pH=a |
| II | c1 | 0.2 | pH=7 |
| III | 0.2 | 0.1 | pH>7 |
| IV | 0.1 | 0.1 | pH=9 |
分析 ①常温下,强酸弱碱盐溶液呈中性,溶液的pH=7;
②混合溶液呈中性,则溶液中c (OH-)=c (H+),根据电荷守恒判断c(A-)、c(Na+)相对大小;
③二者等体积混合后溶液中溶质为等物质的量浓度的NaA和HA,混合溶液pH>7,溶液呈碱性,说明NaA水解程度大于HA电离程度,则NaA是强碱弱酸盐,溶液呈存在HA电离平衡、NaA水解平衡;
④二者恰好完全反应生成NaA,混合溶液pH=9,溶液呈碱性,由水电离出的c (OH-)=$\frac{{K}_{w}}{c({H}^{+})}$.
解答 解:①常温下,强酸弱碱盐溶液呈中性,溶液的pH=7,如果HA是强酸,则NaA是强酸强碱盐,混合溶液的pH=7,则a=7,故答案为:=;
②混合溶液呈中性,则溶液中c (OH-)=c (H+),根据电荷守恒得c(A-)=c(Na+),故答案为:=;
③二者等体积混合后溶液中溶质为等物质的量浓度的NaA和HA,混合溶液pH>7,溶液呈碱性,说明NaA水解程度大于HA电离程度,则NaA是强碱弱酸盐,所以HA是弱酸,溶液呈存在HA电离平衡、NaA水解平衡,分别为HA?H++A-、A-+H2O?HA+OH-,
故答案为:弱酸;HA?H++A-;A-+H2O?HA+OH-;
④二者恰好完全反应生成NaA,混合溶液pH=9,溶液呈碱性,由水电离出的c (OH-)=$\frac{{K}_{w}}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-9}}$mol/L=10-5 mol/L,
故答案为:10-5 mol/L.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析判断及计算能力,明确混合溶液中溶质成分及其性质是解本题关键,注意结合溶液pH大小分析解答,题目难度中等.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定是甲烷和乙烷 | ||
| C. | 混合气体中可能含有乙烷 | D. | 混合气体中一定没有乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:3:2 | B. | 2:2:3 | C. | 3:28:27 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱、烧碱均属碱 | B. | SiO2、CO2均属于酸性氧化物 | ||
| C. | 凡能电离出H+的化合物均属酸 | D. | 非金属氧化物一定是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
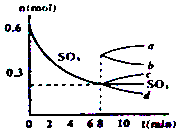 在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示:
在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、CO32- | B. | Na+、HCO3- | C. | CO32-、HCO3- | D. | Na+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
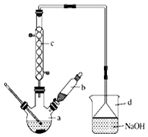 溴苯是一种化工原料,实验室合成溴体的装置示意图及有关数据如表:
溴苯是一种化工原料,实验室合成溴体的装置示意图及有关数据如表:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
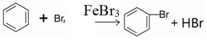 ;装置d的作用吸收HBr和溴蒸气;防止倒吸.
;装置d的作用吸收HBr和溴蒸气;防止倒吸.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com