
| A. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| B. | 常温下,饱和氯水中c(H+)-c(OH-)═c(Cl-)+C(ClO-) | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH小 |
分析 A.pH=4的醋酸溶液稀释,则醋酸分子电离的个数增加,但溶液体积也在增加,会导致H+个数增加,浓度降低,但c(OH-)浓度会增加;
B.常温下,饱和氯水中存在电荷守恒,结合电荷守恒表达式解答;
C.pH与体积均相同的盐酸和醋酸,醋酸浓度远大于盐酸;
D.常温下,同浓度的Na2S与NaHS溶液相比,由于Na2S水解程度大于NaHS,显碱性.
解答 解:A.pH=4的醋酸溶液稀释,则醋酸分子电离的个数增加,会导致H+个数增加,但溶液体积也在增加,因此c(H+)=$\frac{n({H}^{+})}{V}$总的来说是降低的,溶液中c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$却是升高的,并不是溶液中所有离子浓度均降低,故A错误;
B..常温下,饱和氯水中存在电荷守恒:c(H+)=c(OH-)+c(Cl-)+c(ClO-),整理可得c(H+)-c(OH-)=c(Cl-)+c(ClO-),故B正确;
C.pH与体积均相同的盐酸和醋酸,醋酸浓度远大于盐酸,这是由于醋酸是弱电解质,存在电离度而产生的结果,那么中和pH与体积均相同的盐酸和醋酸,消耗NaOH的物质的量应为醋酸消耗的多,故C错误;
D.常温下,同浓度的Na2S与NaHS溶液相比,由于Na2S水解程度大于NaHS,显碱性,因此Na2S溶液的pH值更大,故D错误.
故选B.
点评 本题考查溶液的pH值计算,溶液中的守恒思想,弱电解质的电离平衡,盐类水解的知识.题目难度不大,是基础题.


科目:高中化学 来源: 题型:选择题

| A. | ZM2分子中各原子的最外层均满足8电子稳定结构 | |
| B. | 离子半径:M->Z2->Y- | |
| C. | 电负性:Y>Z>M | |
| D. | Z元素基态原子最外层电子排布图为: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应③的原料是由反应①、②提供的 | |
| B. | 反应③可以作为解决温室效应方案之一 | |
| C. | 反应CH3OH(g)═CO (g)+2H2(g)的△H=(-b-c)kJ•mol-1 | |
| D. | 反应 2CO(g)+4H2 (g)═CH3OCH3 (g)+H2O(l)的△H=( 2b+2c+d ) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46g乙醇分子中含有极性键的数目为6NA | |
| B. | 分子数为NA的CO、C2H4混合气体体积为22.4L,质量为28g | |
| C. | $\frac{1}{18}$mol的H35Cl分子所含中子数为NA | |
| D. | 加热条件下,1molH2与1molI2混合,该反应过程中转移的电子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目 的 | 分离方法 | 原 理 |
| A | 除去丁醇中的乙醇 | 蒸馏 | 丁醇与乙醇的沸点相差较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| D | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
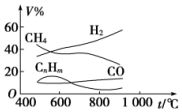 煤的气化是煤高效、洁净利用的方向之一.如图为加热某地煤样所得煤气组成及体积分数随温度变化的曲线图.由图可知该煤气中( )
煤的气化是煤高效、洁净利用的方向之一.如图为加热某地煤样所得煤气组成及体积分数随温度变化的曲线图.由图可知该煤气中( )| A. | 只含有碳、氢两种元素 | B. | 所含的有机物是CH4、CnHm | ||
| C. | CO体积分数大于CH4体积分数 | D. | 低温有助于提高H2的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属冶炼的本质是将化合态金属还原为游离态,冶炼方法由金属的活泼性决定 | |
| B. | 可以用钠加入氯化镁饱和溶液中制取镁 | |
| C. | 炼铁高炉中所发生的反应都是放热的,故无需加热 | |
| D. | 由于Al的活泼性强,故工业上采用电解熔融AlCl3的方法生产Al |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com