
| A.FeSO4·7H2O是常用的混凝剂,它除去悬浮固体颗粒的过程只是物理过程 |
| B.用纯碱和生石灰处理硬水,既可以除去暂时硬度,也可以除去永久硬度 |
| C.永久硬度的水可以采用离子交换法进行软化,其主要就是利用了离子交换膜技术 |
| D.污水处理中的三级处理是采用化学方法,对污水进行深度处理和净化 |
 渗析法是一种常用的海水淡化的方法,使用到的离子交换膜只有阳离子交换膜
渗析法是一种常用的海水淡化的方法,使用到的离子交换膜只有阳离子交换膜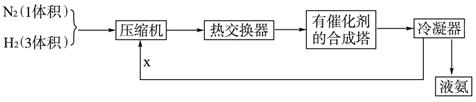
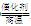 3H2+CO(或CH4+2H2O
3H2+CO(或CH4+2H2O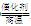 4H2+CO2),(2分) N2与H2,(1分)
4H2+CO2),(2分) N2与H2,(1分) NH3·H2O+H+,CO32—+H2O
NH3·H2O+H+,CO32—+H2O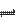 HCO3—+OH—,这两种离子相互促进对方水解程度,使得NH4+变成易分解挥发的NH3·H2O,使肥效降低。(2分)
HCO3—+OH—,这两种离子相互促进对方水解程度,使得NH4+变成易分解挥发的NH3·H2O,使肥效降低。(2分)

科目:高中化学 来源:不详 题型:单选题
| A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强 |
| C.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
| D.生铁浸泡在食盐水中发生吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
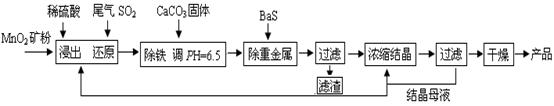
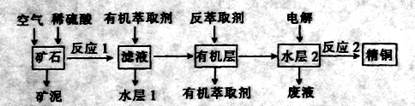
 的产物是Mn3O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是 ▲
的产物是Mn3O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是 ▲ 
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
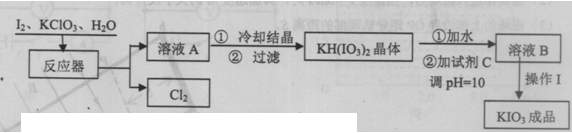
 2)生产过程中,在反应器中加入反应物之后,还需加入硝酸酸化并保持微沸1小时,加硝酸的目的是 。微沸1小时的目的是 。
2)生产过程中,在反应器中加入反应物之后,还需加入硝酸酸化并保持微沸1小时,加硝酸的目的是 。微沸1小时的目的是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.硫酸铵 | B.磷酸二氢钙 | C.硫酸钾 | D.尿素 |

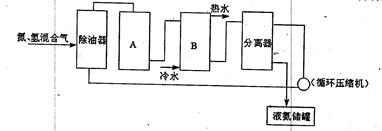
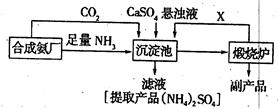
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.25% | B.33% | C.50% | D.66.6% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com