
| A.NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7 mol/L |
| B.Na2CO3溶液中,2c(Na+)=c(CO)+c(HCO)+c(H2CO3) |
| C.pH相等的①NH4NO3、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH)大小顺序为:①>②>③ |
| D.10 mL pH=12的氢氧化钠溶液中加入pH=2的HA溶液至pH刚好等于7,则所得溶液体积V(总)=20 Ml |
科目:高中化学 来源:不详 题型:单选题
| A.1 mol/L H2SO4溶液 | B.2 mol/L Na2SO4溶液 |
| C.0.1 mol/L BaCl2溶液 | D.纯水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.温度一定时,当溶液中c(Ba2+)×c(SO42-)=1.07×10-10时,此溶液为BaSO4的饱和 溶液 |
| B.因为Ksp(BaCO3)>Ksp(BaSO4),所以无法将BaSO4转化为BaCO3 |
| C.25 ℃ 时,在未溶解完BaCO3的饱和溶液中滴入少量Na2SO4溶液后有BaSO4沉淀析 出,此时溶液中c(CO32-)∶c(SO42-)=24.11 |
| D.在饱和BaCO3溶液中加入少量Na2CO3固体,可使c(Ba2+)减小,BaCO3的溶度积不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
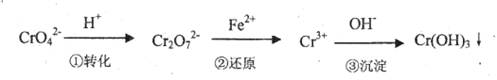
 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1×10-3% | B.2×10-4% | C.9×10-3% | D.2.5×10-20% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液的pH增大 | B.溶液的pH减小 |
| C.溶液中Ca2+浓度保持不变 | D.溶液中Ca2+物质的量保持不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Ag+(aq)+Cl-(aq),若把AgCl分别放入①100mL0.1mol/LNa2SO4溶液中;②100mL0.1mol/L NaCl溶液中;③100mL0.1mol/L AlCl3溶液中;④100mL0.1mol/L MgCl2溶液中。搅拌后在相同的温度下Ag+浓度由大到小的顺序是:
Ag+(aq)+Cl-(aq),若把AgCl分别放入①100mL0.1mol/LNa2SO4溶液中;②100mL0.1mol/L NaCl溶液中;③100mL0.1mol/L AlCl3溶液中;④100mL0.1mol/L MgCl2溶液中。搅拌后在相同的温度下Ag+浓度由大到小的顺序是:| A.①>②>④>③ | B.②>①>④>③ | C.④>③>②>① | D.①>④>③>② |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Ag+ + Cl-,平衡时,c(Ag+)·c(C-)="Ksp" ,过量氯化银分别投入①100 mL水 ②24 mL 0.1 mol·L-1NaCl ③10 mL 0.1 mol·L-1MgCl2 ④30 mL 0.1 mol·L-1AgNO3溶液中,溶液中c(Ag+)大小顺序为
Ag+ + Cl-,平衡时,c(Ag+)·c(C-)="Ksp" ,过量氯化银分别投入①100 mL水 ②24 mL 0.1 mol·L-1NaCl ③10 mL 0.1 mol·L-1MgCl2 ④30 mL 0.1 mol·L-1AgNO3溶液中,溶液中c(Ag+)大小顺序为| A.③①②④ | B.④①②③ | C.①②③④ | D.④③②① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.两种难溶盐电解质,其中Ksp小的溶解度一定小 |
| B.向含有AgCl固体的溶液中加入适量的水使AgCl溶解又达到平衡时,AgCl的溶度积不变,其溶解度也不变 |
| C.将难溶电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积 |
| D.溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则Ksp小的一定先生成沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com