
(1 4分)X.Y、Z、W是元素周期表前四周期中常见的元素,原子序数依次增大,其相关信息如下表
元素 | 相关信息 |
X | 由X形成的单质是最清洁的能源 |
Y | 基态原子核外p能级电子总数比s能级少一个 |
Z | 由Z形成的多种单质,其中之一是地球生物的“保护伞” |
W | 含量位居地壳中金属元素的第二位 |
回答下列问题:
(1)Z位于元素周期表第 周期第 族,W的基态原子核外电子排布式为 。
(2)Y的第一电离能比Z (填“大”或者“小”);由X、Y、Z三种元素组成的一种盐的化学式为 。
(3)写出W元素的单质与X2Z在高温条件下反应的化学方程式 。
(4)在500℃、30MPa下,将1mol X2 与足量的Y2 置于密闭容器中充分反应生成YX3,当X2 的转化率为25%时,放出热量为7.7kJ,则该反应的热化学方程式为: 。
(14分)
(1)二(1分)VIA(2分) [Ar]3d64s2(或1s22s22p63s23p63d64s2)(2分)
(2)大(2分)NH4NO3或NH4NO2 (2分)
(3)3Fe+4H2O(g) Fe3O4+4H2 (2分)
Fe3O4+4H2 (2分)
(4)N2(g)+3H2(g) 2NH3(g) H=—92.4kJmol1 (3分)
2NH3(g) H=—92.4kJmol1 (3分)
【解析】
试题分析:由X形成的单质是最清洁的能源,则X为H元素;Y的基态原子核外p能级电子总数比s能级少一个,则Y基态原子核外电子排布为:1s22s22p3,则Y为N元素;能作为地球生物的“保护伞”的单质为O3,则Z为O元素;W的含量居地壳中金属元素的第二位,则W为Fe元素。
(1)Z为O元素,位于元素周期表第二周期第VIA族;W为Fe元素,原子序数为26,则W的基态原子核外电子排布式为:[Ar]3d64s2(或1s22s22p63s23p63d64s2)。
(2)N原子2p轨道排布了3个电子,为半充满状态,更稳定,N的第一电离能大于O的第一电离能;H、N、O元素可形成NH4NO3或NH4NO2两种盐。
(3)W元素的单质为Fe,X2 Z为H2O,Fe与水蒸气在高温条件下反应生成Fe3O4和H2,化学方程式为:3Fe+4H2O(g) Fe3O4+4H2
Fe3O4+4H2
(4)首先写出N2与H2反应的化学方程式并注明状态,N2(g)+3H2(g) 2NH3(g),N2的转化率为25%时,反应了0.25mol的H2,则H=7.7kJ÷0.25mol×3=—92.4kJmol1,可得热化学方程式。
2NH3(g),N2的转化率为25%时,反应了0.25mol的H2,则H=7.7kJ÷0.25mol×3=—92.4kJmol1,可得热化学方程式。
考点:本题考查原子结构、电子排布、第一电离能的比较、化学方程式和热化学方程式的书写。


科目:高中化学 来源:2014-2015学年山东省济南市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列有关反应的离子方程式的书写中,正确的是
A.C12通入水中:C12+H2O=2H++Cl-+ClO-
B.硫酸铝溶液与过量氨水反应:Al3++3NH3·H2O=3NH4++Al(OH)3↓
C.实验室用石灰石和盐酸反应制取CO2:CO32-+2H+=H2O+CO2↑
D.向Na2SO3溶液中加入稀硝酸:SO32-+2H+=H2O+SO2↑
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考化学试卷(解析版) 题型:选择题
赤铜矿的成份是Cu2O,辉铜矿的成份是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:
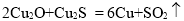 ,对于该反应,下列说法正确的是
,对于该反应,下列说法正确的是
A.该反应的氧化剂只有Cu2O
B.Cu既是氧化产物又是还原产物
C.每生成1 mol Cu,还原剂转移给氧化剂的电子为2 mol
D.该反应中氧化产物与还原产物的质量比为1∶6
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省淮南市高三一模理综化学试卷(解析版) 题型:填空题
(14分)邻羟基桂皮酸(D)是合成香精的重要原料,下列为合成邻羟基桂皮酸的路线之一
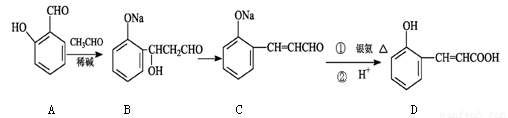
试回答:
(1)A中含氧官能团的名称是 和 。
(2)B→C的反应类型 。
(3)D与过量NaOH溶液反应的化学方程式 。
(4)有机物E与D互为同分异构体,且E有如下特点:
① 是苯的对位取代物, ② 能与NaHCO3反应放出气体 ,③能发生银镜反应。
请写出E的一种结构简式 。
(5)下列说法正确的是 。
a.A的化学式为C7H8O2 b.B能与NaHCO3溶液反应
c.C可能发生聚合反应 d.1mol有机物D最多能与4mol H2加成
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省淮南市高三一模理综化学试卷(解析版) 题型:选择题
常温下,下列各组微粒在指定溶液中一定能大最共存的是
A.由水电离的c(H+)=1×l0-14mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
B.pH=1的溶液中:K+、Cr2O72-、SO42-、CH3CHO
C.加石蕊呈蓝色的溶液中:Na+、K+、AlO2-、NO3-
D.0.1mol/LFeCl3溶液中:NH4+、Na+、SCN-、Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省合肥市高三第一次教学质量检测化学试卷(解析版) 题型:选择题
下列关于乙酰水杨酸(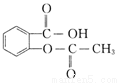 )说法正确的是
)说法正确的是
A.能发生水解反应 B.能发生消去反应
C.不能发生酯化反应 D.不能发生加成反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省合肥市高三第一次教学质量检测化学试卷(解析版) 题型:选择题
常温下,下列微粒在指定溶液中一定能大量共存的是
A.在能使石蕊试液变红的溶液中:Ba2+ 、Cu2+ 、NO3― 、Cl―
B.在pH=13的溶液中:K+ 、Mg2+ 、Cl―、SO32―
C.在乙醛水溶液中:K+ 、Na+ 、Cl― 、Br2
D.在由水电离c(H+)=1×10—12mol/L 的溶液中:Na+ 、K+ 、HCO3― 、CH3COO―
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省攀枝花市高一上学期期末考试化学试卷(解析版) 题型:选择题
在KCl、MgSO4、MgCl2形成的混合溶液中,c(K+)=0.1mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.2mol/L,则c(SO42-)为
A.0.15 mol/L B.0.20 mol/L C.0.25 mol/L D.0.40 mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省德镇市高二上学期期末化学试卷(解析版) 题型:填空题
(6分)水溶液中存在多种平衡,请根据所学化学知识回答下列问题:
(1)在浓度均为0.1mol/L①CH3COONH4 ②NH4HSO4 ③NH3.H2O ④(NH4)2SO4溶液中,NH4+浓度由大到小的顺序为(填序号) 。
(2)浓度均为0.1 mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵四种溶液中的H+浓度由大到小的顺序是(填序号) 。
(3)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com