
| A. |  | B. |  | C. |  | D. | 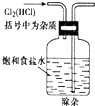 |
分析 A.用天平称量药品时遵循“左物右砝”原则,且称量时NaOH要放在小烧杯中;
B.配制一定物质的量浓度溶液时,转移液体应该用玻璃棒引流;
C.铁离子水解生成氢氧化铁;
D.洗气时导气管应该遵循“长进短出”原则.
解答 解:A.用天平称量药品时遵循“左物右砝”原则,NaOH有强烈腐蚀性,所以称量时NaOH要放在小烧杯中,故A错误;
B.配制一定物质的量浓度溶液时,转移液体应该用玻璃棒引流,否则易溅出液体而导致配制溶液有误差,故B错误;
C.铁离子水解生成氢氧化铁胶体,所以可以用饱和硫酸铁溶液制取氢氧化铁胶体,故C错误;
D.洗气时导气管应该遵循“长进短出”原则,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,侧重考查实验操作,明确基本操作方法及实验原理是解本题关键,注意从实验操作规范性及评价性分析,易错选项是D.


科目:高中化学 来源: 题型:解答题
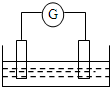 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于(a-0.8 )g | B. | 大于(a-0.8 )g | C. | 大于(a-2.67)g | D. | 等于(a-2.67)g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
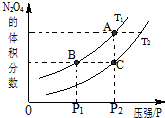 试运用所学知识,研究CO等气体的性质,请回答:
试运用所学知识,研究CO等气体的性质,请回答:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学平衡常数K随温度的升高,K可能增大、减小或不变 | |
| B. | 催化剂不能改变平衡常数的大小 | |
| C. | 对于给定的可逆反应,温度一定时,其正、逆反应的平衡常数可能相等 | |
| D. | 化学平衡移动时,平衡常数不一定改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某学生用pH试纸测新制氯水的pH值,先变红后褪色,是因为Cl2有强氧化性 | |
| B. | 容量瓶、分液漏斗、滴定管在使用前要检查是否漏水 | |
| C. | 为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量 | |
| D. | 将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | TNT的制备: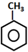 +3HNO3$→_{100℃}^{浓硫酸}$ +3HNO3$→_{100℃}^{浓硫酸}$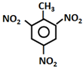 +3H2O +3H2O | |
| B. | 溴乙烷的消去反应:C2H3Br+NaOH$→_{△}^{水}$C2H4↑+NaBr+H2O | |
| C. | 乙醇氧化成乙醛:2C2H5OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O | |
| D. | 乙酸乙酯在碱性条件下水解:CH3COOC2H5+H2O$?_{△}^{碱性}$CH3C0OH+C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给容量瓶中加水时,借助于玻璃棒,给滴定管中装液时,借助于漏斗 | |
| B. | 用梨形分液漏斗做萃取实验时,检漏该分液漏斗上口的方法与检漏容量瓶一样,检漏下方活塞的方法与检漏滴定管一样 | |
| C. | 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后,与标准比色卡比较 | |
| D. | 蒸发操作时,蒸发皿必须放在石棉网上,用酒精灯的外焰加热;水浴加热可以不用温度计 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com