
下列微粒和基团中,碳原子不满足最外层为8电子结构的是
A.一氯甲烷(CH3Cl)
B.甲基(-CH3 )
C.碳负离子(CH3—)
D.乙烯(C2H4)
 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源:2016届四川省成都市高三上学期期中考试化学试卷(解析版) 题型:填空题
T1温度下,体积为 2L的恒容密闭容器,加入4.00molX,2.00molY,发生化学反应 2X(g)+Y(g) 3M(g)+N(s) △H<0。
3M(g)+N(s) △H<0。
部分实验数据如表格所示。
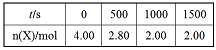
(1)前500s反应速率v(M)=_____,该反应的平衡常数K=_____。
(2)若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是____(填序号)
a.X的消耗速率与M的消耗速率相等 b.混合气体的平均相对分子质量不变
c.v(Y)与v(M)的比值不变 d.固体的总质量不变
(3)该反应达到平衡时某物理量随温度变化如下图所示。纵坐标可以表示的物理量有哪些_____。
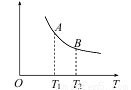
a.Y的逆反应速率
b.M的体积分数
c.混合气体的平均相对分子质量
d.X的质量分数
(4)反应达到平衡后,若再加入3.00molM,3.00molN,下列说法正确的是_____。
A.平衡不移动
B.重新达平衡后,M的体积分数小于50%
C.重新达平衡后,M的物质的量浓度是原平衡的1.5倍
D.重新达平衡后,Y的平均反应速率与原平衡不相等
E.重新达平衡后,用X表示的v(正)比原平衡大
(5)若容器为绝热恒容容器,起始时加入4.00molX,2.00molY,则达平衡后M的物质的量浓度_____1.5mol/L(填“>”、“=”或“<”),理由是_____。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一上学期期中测试化学试卷(解析版) 题型:选择题
CO2、Fe2O3、Na2SO4溶液、Ba(OH)2溶液 、盐酸五种物质,在常温下两种物质间能发生的化学反应有
A.3个 B.4个 C.5个 D.6个
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三上学期期中联考化学试卷(解析版) 题型:填空题
铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中。
(1)铝粉和铁的氧化物(FeO·Fe2O3)可配成铝热剂用于焊接钢轨,反应的化学方程式是 。
(2)NaOH溶液可以除去铝表面的氧化膜,在处理过程中常会产生H2,产生H2的离子方程式是 。
(3)工业上以铝土矿(Al2O3·H2O)为原料生产铝,主要包括下列过程:
i.将粉粹、筛选后的铝土矿溶解在NaOH溶液中;
ii.加入过量的试剂A使所得溶液中析出Al(OH)3固体;
iii.使Al(OH)3脱水生成Al2O3;
iv.电解熔融Al2O3生成Al。
铝土矿粉粹的目的是 ,试剂A的化学式是 ,电解熔融Al2O3时,加入冰晶石,其作用是 。
(4)明矾化学式为KAl(SO4)2·12H2O,向明矾溶液中加入Ba(OH)2溶液,当溶液中的SO42-恰好沉淀时,铝元素的存在形式是 。
(5)美国普度大学研究开发出一种利用铝镓(化学式:AlGa)合金制取氢气的新工艺(如下图所示)。
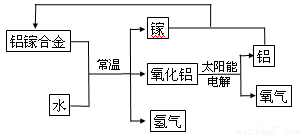
i.写出常温下铝镓合金产生氢气的化学方程式 。
ii.下列有关该工艺的说法正确的是 。
A.该过程中,能量的转化形式只有两种
B.铝镓合金可以循环使用
C.铝镓合金的熔点比金属铝低
D.该工艺可利用太阳能分解水
查看答案和解析>>
科目:高中化学 来源:2016届湖南省澧县、桃源、益阳三校高三上学期联考化学试卷(解析版) 题型:填空题
硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:

查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡[Sn(OH)Cl]。
回答下列问题:
(1)锡元素在周期表中位于第五周期,与碳元素位于同一主族,则锡元素的原子的核电荷数为_______。
(2)操作Ⅰ是_________、冷却结晶________、洗涤、干燥。。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因___________________________。
(4)加入Sn粉的作用有两个:①调节溶液pH,②__________________________。
(5)酸性条件下,SnSO4还可以作双氧水去除剂,发生反应的离子方程式是___________。
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl=SnCl2 + H2↑;
②加入过量的FeCl3 ;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl =6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.19g 锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0 ml。锡粉中锡的质量分数是___________________。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省淮安市高三上学期10月阶段测化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A、氢氧化亚铁溶于稀硝酸中:Fe(OH)2+2H+==Fe2++2H2O
B、向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O=H2SiO3↓+SO32-
C、向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3++4NH3·H2O=[Al(OH)4]-+4NH4+
D、向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川市高三上学期统练(三)化学试卷(解析版) 题型:选择题
COCl2(g)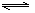 CO(g)+ Cl2(g) ΔH>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④扩大容积 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+ Cl2(g) ΔH>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④扩大容积 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
A.①②④ B.①④⑥ C.②③⑥ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期期中考试化学试卷(解析版) 题型:实验题
我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00mg/L。实验室可用一定浓度的溴水测定某废水中苯酚的含量,其原理如下:

(1)请完成相应的实验步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中。
步骤2:将5.0 mL 0.01mol/L溴水迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤3:打开瓶塞,向锥形瓶中加入过量的0.1mol/L KI溶液,振荡。
步骤4: ,再用0.01 mol/L Na2S2O3标准溶液滴定至终点,消耗 Na2S2O3溶液8.50 mL。(反应原理:I2 + 2Na2S2O3 = 2NaI + Na2S4O6)
(2)该废水中苯酚的含量为 mg/L。
(3)步骤2塞紧瓶塞的原因是 。
(4)步骤3若振荡时间过长,则测得的废水中苯酚的含量 (填“偏高”、“偏低”或“无影响”,下同)。步骤4中若滴定至终点时滴定管尖嘴处出现气泡,而滴定前无气泡,会使测得的废水中苯酚的含量 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林实验中学高二上学期期中考试化学试卷(解析版) 题型:选择题
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中相差不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
根据上述表格中的数据,判断以下说法中不正确的是( )
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中酸性最强的酸
C.在冰醋酸中硫酸的电离方程式可表示为H2SO4=2H++SO
D.水对于这四种酸的强弱没有区分能力,但冰醋酸可以区分这四种酸的强弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com