
常温下,等体积、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如下图所示,下列说法正确的是( )
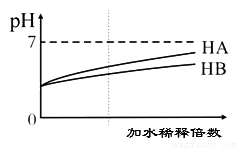
A. 向HB溶液中滴加NaOH溶液的过程中,水的电离程度一直增大
B. 用pH为11的某碱与pH为3的HB溶液等体积混合后,溶液不可能显碱性
C. 氨水与HA溶液混合后的溶液中可能存在:c(NH4+ )>c(A+)>c(H+)>c(OH-)
D. 完全中和等体积等pH的HA、HB两溶液时,消耗同浓度NaOH溶液的体积:HA<HB
科目:高中化学 来源:2017届浙江省温州市高三第二次选考模拟考试(2月)化学试卷(解析版) 题型:填空题
【加试题】氮及其化合物在生活和生产中应用广泛。
(1)N2O是一种强大的温室气体,在一定条件下,其分解的化学方程式为:2N2O(g)=2N2(g)+O2(g) ΔH<0,你认为该反应的逆反应是否自发进行,请判断并说明理由___________。
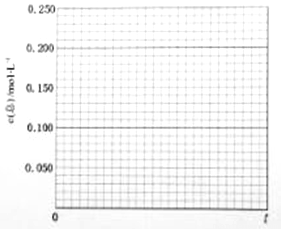
某研究小组为针对N2O的分解进行研究,常温下,在1L恒容容器中充入0.100mol N2O气体,加热到一定温度后使之反应,请画出容器中气体的总浓度c(总)随时间t变化的总趋势图。_____________
(2)①N2O5是一种新型硝化剂。工业上可用N2O4通过电解制备N2O5,阴、阳极室之间用质子交换膜隔开,两极电解液分别为稀硝酸溶液和溶有N2O4的无水硝酸,用惰性电极电解时,生成N2O5极室的电极反应式为_____________。
②已知,一定条件下有下列反应:
Ⅰ2N2O5(g)  4NO2 (g)+ O2(g) ΔH1
4NO2 (g)+ O2(g) ΔH1
Ⅱ2NO2(g)  2NO (g)+ O2(g) ΔH2
2NO (g)+ O2(g) ΔH2
Ⅲ2NaOH(aq)+N2O5(g)=2NaNO3(aq)+H2O(1) ΔH3
写出NO和O2的混合物溶于NaOH溶液生成硝酸盐的热化学方程式___________。
在容积为2L的恒容密闭容器中充入1.00mol N2O5,假设在T℃时只发生反应Ⅰ、Ⅱ,若达到平衡状态后O2为1.00mol,NO2为0.400mol,则T℃时反应Ⅰ的平衡常数的值为_________。
(3)NH3和Cr2O3固体在高温下可以制备多功能材料CrN晶体,其反应为Cr2O3(s)+2NH3(g)  2CrN(s)+3H2O(g)。在800℃时,为降低相同时间内收集到的粗产品中氧的含量,通过提高反应器中NH3(g)流量的工艺手段达成,请解释可能的原因___________。
2CrN(s)+3H2O(g)。在800℃时,为降低相同时间内收集到的粗产品中氧的含量,通过提高反应器中NH3(g)流量的工艺手段达成,请解释可能的原因___________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省六校协作体高二下学期期初化学试卷 题型:选择题
从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作。下列图示对应的装置合理、操作规范的是( )
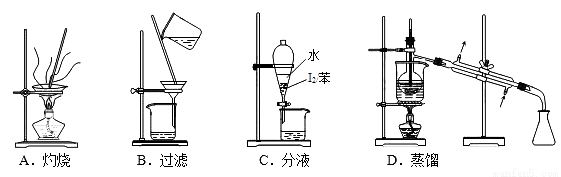
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届陕西省宝鸡市高三教学质量检测(一)理综化学试卷(解析版) 题型:选择题
下列各组有机物的同分异构体种数相同的一组是
A. C4H10与C3H6 B. C5H12与C2H6O
C. C2H2Cl4与CH2Cl2 D. CH2O与C2H4O2
查看答案和解析>>
科目:高中化学 来源:2017届安徽省A10联盟高三下学期开年考试理综化学试卷(解析版) 题型:推断题
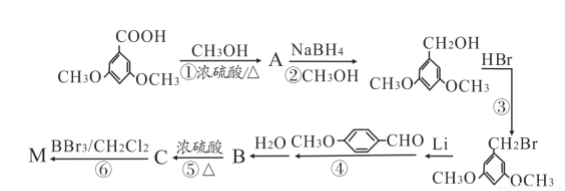
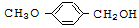
化合物M(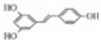 )具有预防心血管疾病的作用,其一种合成路线如下:
)具有预防心血管疾病的作用,其一种合成路线如下:
已知:RCH2Br
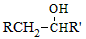
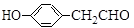
回答下列问题:
(1)M的官能团名称为_____________。③的反应类型是___________。
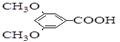 核磁共振氢谱中不同化学环境的氢原子个数比为___________。
核磁共振氢谱中不同化学环境的氢原子个数比为___________。
(2)写出①的化学方程式____________________。
(3)B的结构简式为__________________。
(4)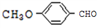 有多种同分异构体,其中能发生银镜反应且苯环上一氯取代物只有两种的同分异构体有_________________种。
有多种同分异构体,其中能发生银镜反应且苯环上一氯取代物只有两种的同分异构体有_________________种。
(5)参照上述合成路线,设计由乙烯合成2-丁醇的合成路线(用合成路线流程图表示,并注明反应条件,合成过程中只有无机试剂可任选)_______________________。
查看答案和解析>>
科目:高中化学 来源:2017届安徽省A10联盟高三下学期开年考试理综化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A. 标准状况下,11.2LH2和D2的混合气体中所含的质子数为NA
B. 1L0.5mol·L-1Na2CO3溶液中阴离子的总数为0.5NA
C. 28g乙烯和丙烯的混合物中所含碳碳双键的数目为NA
D. 向足量水中通入1mol氯气,反应中转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省汕头市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A. 向氯化铝溶液中加入过量氨水:4NH3·H2O+Al3+===AlO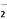 +4NH
+4NH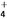 +2H2O
+2H2O
B. 将铝片打磨后置于NaOH溶液中:2Al+2OH-===2AlO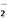 +H2↑
+H2↑
C. 向明矾溶液中加入Ba(OH)2溶液至SO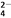 完全沉淀:Al3++2SO
完全沉淀:Al3++2SO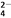 +2Ba2++4OH-===2BaSO4↓+AlO
+2Ba2++4OH-===2BaSO4↓+AlO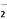 +2H2O
+2H2O
D. 水玻璃中通入过量的二氧化碳的离子方程式为:SiO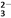 +CO2+H2O===H2SiO3↓+CO
+CO2+H2O===H2SiO3↓+CO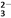
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省汕头市高一上学期期末考试化学试卷(解析版) 题型:选择题
“分类”是一种思想方法,在化学发展中起到了重要的作用。下列说法正确的是( )
A. Na2O和Na2O2均能与H2O反应生成NaOH,故二者都是碱性氧化物
B. 根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
C. 根据水溶液能否导电将化合物分为电解质和非电解质
D. 碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高一上学期期末考试化学试卷(解析版) 题型:简答题
I、实验室中常用MnO2氧化浓盐酸的方法制取氯气,实验装置如图所示:
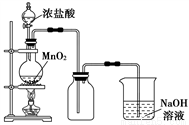
(1)圆底烧瓶中发生反应的化学反应方程式是__________________。
(2)如果将过量二氧化锰与20 mL 12 mol·L-1的盐酸混合加热(忽略盐酸的挥发),充分反应后生成的氯气明显_________(填大于、等于、小于)0.06 mol。其主要原因有_____________________________;
(3)写出尾气处理的离子方程式是_______________________。
II、用Na2CO3·10H2O晶体,配制0.2 mol·L-1的Na2CO3溶液480 mL。
(1)应称取Na2CO3·10H2O晶体的质量:____________。定容时,向容量瓶中加水,至1~2cm时,改用_________加水至刻度,加盖摇匀;
(2)下列操作对所配溶液的浓度可能产生影响
①Na2CO3·10H2O晶体失去了部分结晶水 ②用“左码右物”的称量方法称量晶体(使用游码) ③碳酸钠晶体不纯,其中混有氯化钠 ④容量瓶未经干燥使用。 其中引起所配溶液浓度偏高的有______________(填序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com